- 1
- 2
- 3
- 首页
- 关于平台
平台简介
本科学实验服务平台是莱艾特科技联合中国农业大学科研团队,携手美国芝加哥大学、加拿大McMaster大学、中科院、中国检科院、北京市营养源研究所等国内外一流大学、科研机构和企业资深专家,搭建的技术服务平台。运用国内外先进技术与设备、洁净动物房和良好的实验室,为生命科学实验提供食品、药品安全评估、营养保健品功能评价、动物疫病诊断等技术服务。
- 动物实验平台
整体实验外包
动物实验操作
小动物活体成像
动物行为学
深度分析数据及论文指导
动物分组
活体成像仪使用
水迷宫
课题开展与管理
体重监测
活体成像
十字迷宫
实验方案设计指导
肿块监测
动物模型
八壁迷宫
文献分析与选题指导
实验给药操作
肠炎模型
Y迷宫
实验动物寄养
动物麻醉操作
肥胖与糖尿病模型
T迷宫
SPF级大、小鼠饲养
动物解剖及组织提取
非酒精性脂肪肝
矿场实验
SPF级大、小鼠高脂饲养
采血及分离血清
基因型鉴定
普通级兔、犬、猴、猫、猪、牛、羊饲养
尸体处理
- 病理技术平台
制片前处理
染色
尼氏染色
免疫技术
骨组织脱钙
HE染色
肥大细胞染色
免疫组化
组织脱水
番红固绿(植物/软骨)染色
苯胺蓝染色
免疫荧光(单染)
石蜡包埋
Masson染色
LFB髓鞘染色
免疫荧光(双染)
OCT包埋
天狼猩红染色
普鲁士蓝染色
免疫组化芯片
石蜡白片
PAS糖原染色
VG/EVG染色
组织冰冻切片
阿利新蓝染色
维多利亚染色
病理阅片及报告
组织冰冻切片
AB-PAS染色
von kossa染色
拍照/扫描
硬组织切片
油红O(切片)染色
茜红素染色
阅片/读片
摊片烤片
瑞氏吉姆萨染色
抗酸染色
病理诊断
切片封片
甲苯胺蓝染色
富尔根染色
病理报告
- 检测技术平台
生化分析检测
血常规检测
氨基酸 | 脂肪酸分析
药残 | 微生物检测
前处理-组织匀浆
白细胞 | 红细胞 | 血红蛋白
游离脂肪酸
盐酸克伦特罗 | 四环素
丙氨酸氨 | 天门冬氨酸基转移酶
单核细胞数 | 单核细胞比率
短链脂肪酸
莱克多巴胺 | 沙丁胺醇 | 己烯雌酚
γ-谷氨酰基转移酶 | 脂肪酶
嗜酸细胞数 | 嗜酸细胞比率
18种不饱和脂肪酸
黄曲霉素 | 伏马毒素 | 氰化物
总胆红素 | 直接胆红素
淋巴细胞数 | 淋巴细胞比率
氨基酸分析
沙门氏菌 | 细菌总数 | 大肠菌群
尿素 | 肌酐 | 总蛋白 | 白蛋白
中性粒细胞数 | 中性粒细胞比率
甘油三酯 | 总胆固醇
红细胞压积 | 淋巴细胞数
细胞流式
其它检测实验
高密度 | 低密度脂蛋白胆固醇
血小板 | 血小板平均体积
细胞培养 | 原代细胞培养
微量元素含量检测
葡萄糖 | 尿酸 | 乳酸脱氢酶
血小板体积分布宽度标准差
流式细胞培养 | 流式细胞检测
饲料概略养分分析
- 分子蛋白平台
实时荧光定量PCR
Western Blot检测服务
质粒扩增与提取
定量PCR标准曲线构建
qPCR相对定量
细胞 | 组织蛋白提取
凝胶阻滞迁移电泳(EMSA)
定量PCR标准品构建
基因组DNA抽提
Western Blot
染色质免疫沉淀(ChIP)
Taqman探针设计与合成
RNA提取+反转录
考马斯亮蓝染色
免疫共沉淀(Co-Ip)
qPCR引物设计合成
RNA提取+反转录
明胶酶谱
- 4
科学实验一站式服务平台


猴椅保定训练对恒河猴应激的影响
赵 琪1,2 刘永涛1 周 超1 兰艳丽1 汪溪洁1,2 李彩云1
(1.上海益诺思生物技术股份有限公司,上海201203)(2.中国医药工业研究总院,上海 201203)
摘 要:[目的] 考察恒河猴猴椅保定30 min连续5次适应性对应激激素水平的影响。[方法] 约3岁恒河猴,雌雄各15只,分3组,每组 10 只,雌雄各半进行猴椅保定适应性训练,每间隔1d训练1次,每次训练 30 min。组1:不进行适应性训练组,组2:单纯适应性训练组,组3:给予零食和安抚训练组,共训练5次,每次训练结束对3组所有动物采血分析。[结果]与组1相比,组2和组3在多次猴椅保定适应性训练后可见猴血清皮质酮(CROT)显著性降低(P<0.05 或 P<0.01),组3的猴β-内啡肽(β-EP)显著降低(P<0.05 或 P<0.01),组3于第1和第5次适应性训练后 5-羟色胺(5-HT)升高(P<0.01)。[结论] 进行猴椅保定的适应性训练能显著降低恒河猴的应激压力,让动物趋于习惯或适应坐猴椅保定的操作。在适应性训练中,给予正向强化的训练方式让受试者在减少应激和攻击性表现更显著,适应性保定训练3~4次就可以让应激压力降到恒定水平。
关键词:非人灵长类;保定;应激;皮质酮;内啡肽;5-羟色胺
中图分类号: 095-3 文献标志码: A 文章编号:1006-6179(2024)02-0074-04 DOI:10.3969/j.issn.1006-6179.2024.02.012
在生物医药研究中,非人灵长类动物是不可或缺的重要实验对象,应用于各种研究领域,包括神经生理学、神经内分泌学、实验心理学、自主生理学和药理学。当进行这些实验研究时,让非人灵长类动物坐在特制的猴椅进行物理保定是常规操作。用于均束非人灵长类动物的猴椅已被证明适用于需要较长时间的操作中,如留置套管或瘘管,连接电极导发,频繁采集血液或尿液样本,以及药物静脉滴注,这些实验操作通常要求动物长时间坐在原地或要求动物与人密切接触[1]。经过不断的改进,目前吏用广泛的猴椅是一种先给动物佩戴一个容易连接到杆子上的项圈,杆子可用来引导动物在它的生活笼子和保定装置之间。然后,项圈滑入保定装置固定,头部可自由转动,同时身体会保持一种坐姿或者站姿,四肢可根据操作需要进行固定或不进行固定,这种保定猴椅适用于灵长类动物的多类型实验,最大程度考虑到了动物的舒适性、安全性以及可操作性,减少了频繁的抓取操作。
众所周知环境应激影响动物的行为、神经内分泌和免疫活动。应激通常认为是对体内平衡的生理、生化或心理的扰动,同时伴随免疫功能参数的变化[2]。猴椅保定是其中一项非常明确稳定的应激,有研究表明猴椅保定能够激活HPA(下丘脑垂体-肾上腺)系统[3],随着对猴椅保定的不断适应,HPA系统反应将被减弱,但不会被消除。适应或习惯化都预示着反复暴露于应激源会减少HPA系统敫素的分泌,表现出行为适应性变化和生理习惯化。非人灵长类动物猴椅保定约束对各种生理系统的影向一直是很少被系统研究的,特别是关于不同身体系统稳定适应所需的时间问题,以及与不进行适应性训练的非人灵长类动物相比,进行了猴椅适应性训练的灵长类动物是否存在生理差异。且随着研究手段的提高,新技能新方法的出现,在进行猴椅适应生训练时,也出现了多种方式和方法,例如正向强化训练是目前比较推崇的进行动物驯化和训练的手段[4]。本实验选取科学研究中常用的猴椅适应性训练保定时长,训练次数,增加正向强化训练的方式,考察恒河猴的生理激素指标的变化。
1材料和方法
1.1材料
1.1.1实验动物:普通级,恒河猴,雌雄各15只,约3岁,体质量2~3kg,动物来源:广西雄森灵长类实验动物养殖开发有限公司,生产许可证号为SCXK(桂)2021-0004。实验动物饲养于上海益诺思生物技术股份有限公司普通级动物饲养室内,使用许可证号为SYXK(沪)2019-0009.温度18-26℃.湿度40%~70%。进入本实验的所有动物均完成检疫,本实验的开展通过IACUC批准(批准号:IACUC2022-M-028)。实验动物的饲养和实验动物的使用均符合3R原则并给予人道的关怀。
1.1.2 试剂与耗材:猴血清皮质酮(CROT,批号E20220909-70969A)、猴β-内啡肽(β-EP,批号E20221213-70433A)、猴血清素(5-色胺,5-HT.批号E20221213-70098A)、ELISA 试剂盒,购于上海通蔚实业有限公司。
1.2 方法
1.2.1 动物筛选和分组:参照药物安全性评价指导原则,选取检疫合格的40只雌雄各半恒河猴,检测血液生化指标进行健康筛选,最后选取30只雌雄各半的健康动物进入本实验。实验分3组,每组10只动物,雌雄各半,参照毒理评价中常规动物数量,收集每组雌雄各5只数据,为最少动物需求量。实验期间每只动物配有栖杆、镜子等玩具,自由饮水,每日给予(160±10)g配方饲料,每天添加水果和每周喂坚果2次。动物饲养于不锈钢猴笼(800mmx900mmx890mm,底面积为0.72㎡),实验期间所有动物同组同性别之间进行整夜配对饲养。
1.2.2 实验方法:组1为不做适应性训练组:组2为单纯做猴椅适应性训练组,训练人员将动物放置猴椅后,只对动物的异常行为和安全进行观察或者纠正;组3为在适应性训练给予零食奖励组,训练人员将动物放置在猴椅上,准备猴子爱吃的小零食(小饼干或者葡萄干),大约每2min投喂一次,对于表现烦躁或者异常的动物进行轻声安抚。组2和组3每次训练时长为30min;每次训练间隔1d,训练完成后,3组动物均需采集一次血样用于分析,共训练5次,分别在实验的第2、4、6、8和10天(D2、D4D6、D8、D10)进行。采集的血样采用4000r/min离心10 min 取血清,ELISA 试剂盒检测CROT、β-EP和 5-HT 指标。
1.3 统计学分析
皮质酮、β-内啡肽、5-羟色胺以均数±标准差(至+s)表示。组2和组3与组1相比,用Levene's检验检测数据的方差齐性。若方差齐,则进行单因素方差分析(ANOVA);若方差不齐,则用Dunnett t3检验进行组间比较;P<0.05表示差异有统计学意义。
2 结果
2.1皮质酮检测结果
与组1相比,组2于D6、D8和D10及组3于D2、D6和D8可见CORT降低(P<0.05 或P<0.01)(表1)。

2 2内啡肽检测结果
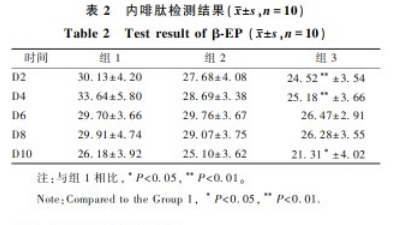
与组1相比,组3于D2、D4和D10可见β-EP降低(P<0.05或P<0.01)(表2)。
2.3 5-羟色胺检测结果
与组1相比,组3于D2和D10可见5-HT升高(P<0.01)(表3)。

3 讨论
本实验组1动物不做适应性训练组,组2动物仅单纯做猴椅适应性训练,组3动物采用了时下被众多动物福利组织和机构推崇的正向强化训练方式进行猴椅适应性训练(positive reinforcement training,PRT)。PRT在增加人与动物的交流、改善动物的健康、进行适应饲养训练、改善兽医护理和研究操作[5]方面成果显著。尤其从行为数据方面,PRT对非人类灵长类动物尤其有益[6-8],但只有少数研究提供了生理学数据来说明训练的潜在好处[6,9]。本研究检测了CORT、β-EP和5-HT 3个指标,其中与组1相比,组2和组3在第3次和第4次保定适性训练后动物CORT有非常明显的降低;与组2比组3动物CORT也是现明显的降低趋势。与组1相比,组2动物β-EP未见明显改变,组3动物于第12次适应性训练时就可见β-EP显著性降低,于第3、4次适应性训练时表现平稳。与组1相比,组动物5-HT未见明显变化,组3动物于第1次和第5次保定训练后可见5-HT显著性升高,另外3次保定训练后虽然无显著性变化,但每次适应性训练后组3动物的5-HT值均高于组1和组2动物。
皮质酮是用于观测应激的关键指标,进行了适应性训练后组2和组3动物的皮质酮都呈现明显降低,说明动物在进行适应性训练后可有效地降低动物应激水平,采用正向强化训练的组3的数据表现更明显,也证实了PRT的训练优势。在这些使用正强化和负强化技术进行静脉穿刺的研究中,经过训练的恒河猴和卷尾猴的血清皮质醇水平表现较低[10];与未经训练的绒猴相比,训练过的狨猴在排泄尿皮质醇方面没有显著变化[6]。Ruys 等[11]选用全部雄性恒河猴每天坐猴椅2h.在持续7d的研究中,受试者表现出行为焦虑和皮质醇浓度的下降。Carlson等[12]研究表明动物在重复经历猴椅保定后出现非常明显的激动行为减少。
β-EP是连接神经内分泌系统和免疫系统的关键物质之一,通过内阿片肽受体对免疫系统发挥调节作用,β-EP也是目前发现的最强的内源性镇痛物质,对动物痛阈的调节具有重要意义[13],当机体有伤痛刺激时,内源性的阿片肽会被释放出来对抗疼痛,在内啡肽的激发下,让个体身心愉悦,免疫功能获得强化[2]。恒河猴在适应性训练后,与组1相比,组2动物的β-EP未见明显改变,表明单纯的适应性训练不能减少动物体内β-EP分泌;组3动物的β-EP分泌可见显著性降低,说明在适应性训练过程中给予安抚和零食可以减少动物β-EP的分泌,无需产生更多的内啡肽释放协助机体对抗应激或压力。
5-HT在动物的攻击性控制中起着关键作用[14]。有研究证明脑脊液中低浓度的5-HT代谢物5-羟基吲哚乙酸与人类和非人灵长类动物攻击或冲动的低阈值具有相关性[15]。与组1相比,组2无显著性差异,组3动物在经过第1次和第5次训练后5-HT显著升高,说明动物的攻击性阈值也在升高,第2~4次的适应性训练5-HT数值虽无统计学上的明显差异,但其数值也明显高于组1和组2,说明采用PRT方式进行适应性训练的恒河猴,能降低动物的攻击性行为。
综上所述,在对恒河猴持续坐猴椅30min的操作前,猴椅适应性训练持续做3~4次可明显减轻动物的应激反应,其中给予受试者零食和安抚的PRT训练方式能更好地降低动物的应激压力,缓解恒河猴的紧张情绪。与不进行适应性训练的动物相比进行单纯适应性训练动物的5-HT未见明显改变,表明单纯的适应性训练操作对降低恒河猴的攻击性行为意义有限,给予受试动物零食和安抚的PRT训练方式可以明显改善恒河猴的攻击行为。
参考文献
[1]JOHN W M,Corticosteroid response to chair restraint in the monkey[J].Am J Physiol,1972.222(5):1291-1294.
[2]MORROW.TESCH J L,MCGLONE J J.and NORMAN R L.Consequences of restraint stress on natural killer cell activity.behavior, and hormone levels in Rhesues Macaques(Macaca mulatta)[J].Phychoneuroendocrino. 1993.18(5/6);383.395.
[3]CAPITANIO J P,MENDOZA S P,LERCHE N.Individual differences in peripheral blood immunological and horonal( Macaca mulatta ):evidence for temporal and situational consistency [J]. Am J Primatol, 1998,44:29-41.
[4]MASON S,PREMEREUR E,PELEKANOS V,et al. Effective chair training methods for neuroscience research involving rhesus macaques( Macaca mulatta )[J].Neurosci Meth. 2019.317:82.93.
[5]LAMBETH S P,HAU J,PERIMAN J E.et al. Positive reinforcement training affects hematologicand serum chemistry values in captive chimpanzees(Pan troglodyes)[J]. Am J Primatol,2006、68:245-256.
[6]BASSETT L,BUCHANAN-SMITH HM,MCKINLEY J.et al.Effects of training on stress-related behavior of the common marmoset ( Callithrix jacchus )in relation to coping wih routine husbandry precedures[J].J Appl Anim Welf Sci. 2003,6,209-220.
[7]PRESCOTT M J,BUCHANAN-SMIH H M,Training nonhumanprimates using positive reinforcement techniques [J].J AppAnim Welf Sci, 2003.6:157-161.
[8]SCHAPIRO S J,BLOOMSMITH M A,LAULE G E.Positive reinforement training as a technique to alter nonhumin primate behavior; quantitative assessments of effectiveness [J].J AppAnim Welf Sci,2003.6:175-187.
[9]CLARKE A S,MASON W A,MOBERG G P. Interspecific contrasts in responses of macaques to transport cage training[J].Lab Anim Sci,1988,38:305-309.
[10]DETTMER E L,PHILLIPS K A.RAGER D R,et al.Behavioal and cortisol responses to repeated capture and venipuncture in Cebus paella [J]. Am J Primatol, 1996, 38:357-362.
[11]RUYS J D,MENDOZA S P,CAPITANIO J P,et al. Behavioral and physiological adaptation to repeated chair restraint in rhesus macaques[J],Physiol Behav,2004.82:205-213.
[12]CARlSON K R. A temporary restraint chair for monkeys [J]Physiol Behav,1972.9:493-494
[13]胡樱,许兰文、杨斐,等.音乐、色彩干预对制动小鼠福利的影响[J].实验动物与比较医学.2007.27(2):71-76.
[14]FERRARI P F,PALANZA P,PARMIGINIS,et al.Serotonin and aggressive behavior in rodents and nohumin primales predispositions and plasticity [J]. Eur J Phamacol. 2005. 526:259-273
[15]HOWELL S,WESTERCAAR D,HOOS B, et al. Serotonergic influences on life-history outcomes in free.ranging mal rhesus macaques [J]. Am J Primatol,2007,69:851-865.
400 - 102 - 1174


咨询热线

莱
艾
特
商
城
扫
一
扫
关
注

京ICP备14028330号-1 京公网安备 11010802039490号
Copyright © 2015 All Rights Reserved www.bjlat.com 设计维护:北京莱艾特科技发展有限公司
郑重声明:引用他人的信息,本网站均已经列明出处。
转载的目的在于学术交流与讨论,若有任何侵犯您的权益之处,请与我们联系删除相关内容。
地址:北京市海淀区天秀路10号中国农大国际创业园3号楼2层2002 邮箱:info@bjlat.com 电话:010-62969989;13661392264








