- 1
- 2
- 3
- 首页
- 关于平台
平台简介
本科学实验服务平台是莱艾特科技联合中国农业大学科研团队,携手美国芝加哥大学、加拿大McMaster大学、中科院、中国检科院、北京市营养源研究所等国内外一流大学、科研机构和企业资深专家,搭建的技术服务平台。运用国内外先进技术与设备、洁净动物房和良好的实验室,为生命科学实验提供食品、药品安全评估、营养保健品功能评价、动物疫病诊断等技术服务。
- 动物实验平台
整体实验外包
动物实验操作
小动物活体成像
动物行为学
深度分析数据及论文指导
动物分组
活体成像仪使用
水迷宫
课题开展与管理
体重监测
活体成像
十字迷宫
实验方案设计指导
肿块监测
动物模型
八壁迷宫
文献分析与选题指导
实验给药操作
肠炎模型
Y迷宫
实验动物寄养
动物麻醉操作
肥胖与糖尿病模型
T迷宫
SPF级大、小鼠饲养
动物解剖及组织提取
非酒精性脂肪肝
矿场实验
SPF级大、小鼠高脂饲养
采血及分离血清
基因型鉴定
普通级兔、犬、猴、猫、猪、牛、羊饲养
尸体处理
- 病理技术平台
制片前处理
染色
尼氏染色
免疫技术
骨组织脱钙
HE染色
肥大细胞染色
免疫组化
组织脱水
番红固绿(植物/软骨)染色
苯胺蓝染色
免疫荧光(单染)
石蜡包埋
Masson染色
LFB髓鞘染色
免疫荧光(双染)
OCT包埋
天狼猩红染色
普鲁士蓝染色
免疫组化芯片
石蜡白片
PAS糖原染色
VG/EVG染色
组织冰冻切片
阿利新蓝染色
维多利亚染色
病理阅片及报告
组织冰冻切片
AB-PAS染色
von kossa染色
拍照/扫描
硬组织切片
油红O(切片)染色
茜红素染色
阅片/读片
摊片烤片
瑞氏吉姆萨染色
抗酸染色
病理诊断
切片封片
甲苯胺蓝染色
富尔根染色
病理报告
- 检测技术平台
生化分析检测
血常规检测
氨基酸 | 脂肪酸分析
药残 | 微生物检测
前处理-组织匀浆
白细胞 | 红细胞 | 血红蛋白
游离脂肪酸
盐酸克伦特罗 | 四环素
丙氨酸氨 | 天门冬氨酸基转移酶
单核细胞数 | 单核细胞比率
短链脂肪酸
莱克多巴胺 | 沙丁胺醇 | 己烯雌酚
γ-谷氨酰基转移酶 | 脂肪酶
嗜酸细胞数 | 嗜酸细胞比率
18种不饱和脂肪酸
黄曲霉素 | 伏马毒素 | 氰化物
总胆红素 | 直接胆红素
淋巴细胞数 | 淋巴细胞比率
氨基酸分析
沙门氏菌 | 细菌总数 | 大肠菌群
尿素 | 肌酐 | 总蛋白 | 白蛋白
中性粒细胞数 | 中性粒细胞比率
甘油三酯 | 总胆固醇
红细胞压积 | 淋巴细胞数
细胞流式
其它检测实验
高密度 | 低密度脂蛋白胆固醇
血小板 | 血小板平均体积
细胞培养 | 原代细胞培养
微量元素含量检测
葡萄糖 | 尿酸 | 乳酸脱氢酶
血小板体积分布宽度标准差
流式细胞培养 | 流式细胞检测
饲料概略养分分析
- 分子蛋白平台
实时荧光定量PCR
Western Blot检测服务
质粒扩增与提取
定量PCR标准曲线构建
qPCR相对定量
细胞 | 组织蛋白提取
凝胶阻滞迁移电泳(EMSA)
定量PCR标准品构建
基因组DNA抽提
Western Blot
染色质免疫沉淀(ChIP)
Taqman探针设计与合成
RNA提取+反转录
考马斯亮蓝染色
免疫共沉淀(Co-Ip)
qPCR引物设计合成
RNA提取+反转录
明胶酶谱
- 4
科学实验一站式服务平台



摘 要
在毒理学研究中,在临床病理采血之前让动物禁食被认为可以降低某些临床化学指标结果的变异性(例如葡萄糖、甘油三酯和胆固醇)。然而,禁食也被视为给动物增加额外压力的因素,因为这些动物已经由于接受可能有毒剂量的供试物及其他与研究相关的操作而处于应激状态。多重应激因素的积累将对实验动物的福利产生负面影响,进而影响研究所产生数据的质量以及对毒理学意义的解读。此外,不同实验机构在毒理学研究开始前的驯化期间对食蟹猴采用不同的饲喂方案(即每天1餐或每天2餐)。因此,为了在毒理学研究前后改善动物福利,我们开展了一项研究,以评估:(1) 在14天驯化期内采用不同饲喂方案,(2) 在毒理学研究中实施不同禁食持续时间,对食蟹猴福利的影响。结果显示,不同驯化饲喂方式对动物体重、血果糖胺以及其他临床病理学参数没有影响。同时,禁食并未导致食蟹猴出现氧化应激(通过测定还原型和氧化型谷胱甘肽评价),但更长的禁食时间导致了糖皮质激素介导的应激反应(表现为皮质醇升高和淋巴细胞(LYMPH)计数下降)、脱水(表现为无机磷升高),以及血糖显著降低——所有这些变化均可对动物福利产生负面影响。我们希望本研究的结果能帮助药物开发人员针对食蟹猴在毒理学研究中选择适当的禁食时长,从而在保证数据质量的前提下提高动物福利。
材料与方法
动物选择与管理
本研究从种群饲养群中选取了15只雌性(35–51月龄,体重2.6–3.6 kg)和20只雄性(35–51月龄,体重2.6–4.4 kg)的食蟹猴。采用群养形式,并尽量让先前已有社会关系的动物伙伴分在一起进行研究。实验开始前,动物在实验室饲养环境中驯化了23天。按照欧洲指导原则(ETS 123),动物按性别群居饲养在符合标准的围栏中(每栏最多3只),并提供垫料进行环境丰容。清洁动物房和进行试验操作期间,动物被单独圈养。
在本研究中采用了两种饲喂方案。禁食日之前的14天驯化期内,动物被提供相同数量的经认证的灵长类饲料。饲喂频率为每天一次(饲喂方案1)或每天两次(饲喂方案2),例如根据体重每天饲喂一次12–16块饼干,或每天两次每次6–8块饼干,以模拟毒理学研究开始前不同的驯化饲养方法。动物可自由饮水。环境控制条件设置为:温度20–26℃,相对湿度30%–70%,每小时换气不少于8次,光暗周期12小时光/12小时暗。在研究相关活动期间,光暗周期可能会被暂时中断。
在试验开始前和结束时,给动物提供了各种笼内丰容装置(包括玩具)以及水果、蔬菜或其他无需分析的食物性丰富物。玩具每周至少更换一次,以保持动物的新鲜感并增加其使用率。
研究设计与采血
在禁食和采血当天,首先在2小时的限定时间内给予猴子食物,然后将剩余食物撤去,此时作为禁食的开始。自禁食开始后约4小时、8小时、12小时和20小时,分别通过股静脉采集血样。 在驯化期间的第1、4、8、11、13和15天记录所有动物的体重。
血液学与临床化学
从已禁食的动物通过股静脉采集血液样本。血液学检测: 取约1.0 mL全血至含有抗凝剂乙二胺四乙酸钾(K2EDTA)的试管中,轻轻颠倒混匀6到8次。使用西门子Advia 2120i全自动血液分析仪进行血液学分析。临床生化检测: 取约1.0 mL全血至血清分离管(不含抗凝剂)中,在室温下静置使其凝固后,于采血1小时内离心(室温,1500–2000×g,10–15分钟)。离心后45分钟内收集血清。在罗氏Modular P全自动生化分析仪上测定血清生化参数,在西门子Immulite 2000分析仪上测定皮质醇浓度。
胰岛素、胰高血糖素和果糖胺分析
采集1.5 mL全血至血清分离管(不含抗凝剂)中,室温下静置凝固后,于采血1小时内离心(室温,1500–2000×g,10–15分钟)。离心后45分钟内分离血清。将血清分成三份,转移至带锥形底的聚丙烯螺旋盖管中:第1管加入250 µL血清用于胰岛素分析,第2管加入50 µL血清用于胰高血糖素分析,第3管加入150 µL血清用于果糖胺分析。血清样本除非立即置于−60°C至−80°C的冰箱中保存,否则一直保存在干冰上。使用贝克曼库尔特Access II仪器上的化学发光免疫测定法定量胰岛素(采用贝克曼库尔特Access超敏胰岛素试剂)。胰高血糖素采用酶联免疫吸附分析法(Merdocia胰高血糖素试剂盒,目录号10-1281-01,瑞典Uppsala)在BioTek Synergy 2微孔板阅读器上测定。果糖胺使用Diazyme糖化血清蛋白(GSP)试剂进行分析。
还原型谷胱甘肽、氧化型谷胱甘肽和半胱氨酸分析
还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)和半胱氨酸(Cys)的测定采用一种衍生化的液相色谱–串联质谱(LC-MS/MS)方法进行。使用AB Sciex的QTRAP® 6500质谱仪(串联四极杆-线性离子阱质谱,配备Turbo V™ ESI离子源)联用岛津Nexera超高效液相色谱系统进行LC-MS/MS分析。
数据分析
所有数据通过比较不同禁食时长(以4小时为基线)下各性别动物的平均值和标准差进行分析。这些比较通过绘制图形检查、统计学检验或两者结合的方式完成。当采用统计检验时,使用双样本t检验判断差异是否具有统计学意义。无论统计显著与否,领域专家均会评估所有效应量估计值,以确定其在实际中是否有意义。所有数据分析均使用R软件(版本4.0.5)完成。
结 果
本研究分两个阶段进行。第一阶段(饲喂方案1)中,所有动物在禁食日之前连续14天每天上午7:00饲喂一次,以模拟其中一种常用的驯化饲养方式。第二阶段(饲喂方案2)中,所有动物在禁食日之前连续14天每天上午7:00和下午1:00各饲喂一次,以模拟另一种驯化饲养方式。因此,后续结果将根据这两个阶段(饲喂方案)分别呈现。
不同驯化饲养方式对体重无影响
在驯化期间,于第1、4、8、11、13和15天测量所有动物的体重。结果表明,无论性别和饲喂方案如何,动物体重均保持稳定,提示在驯化期间每天一次与每天两次饲喂的方案对体重没有影响。
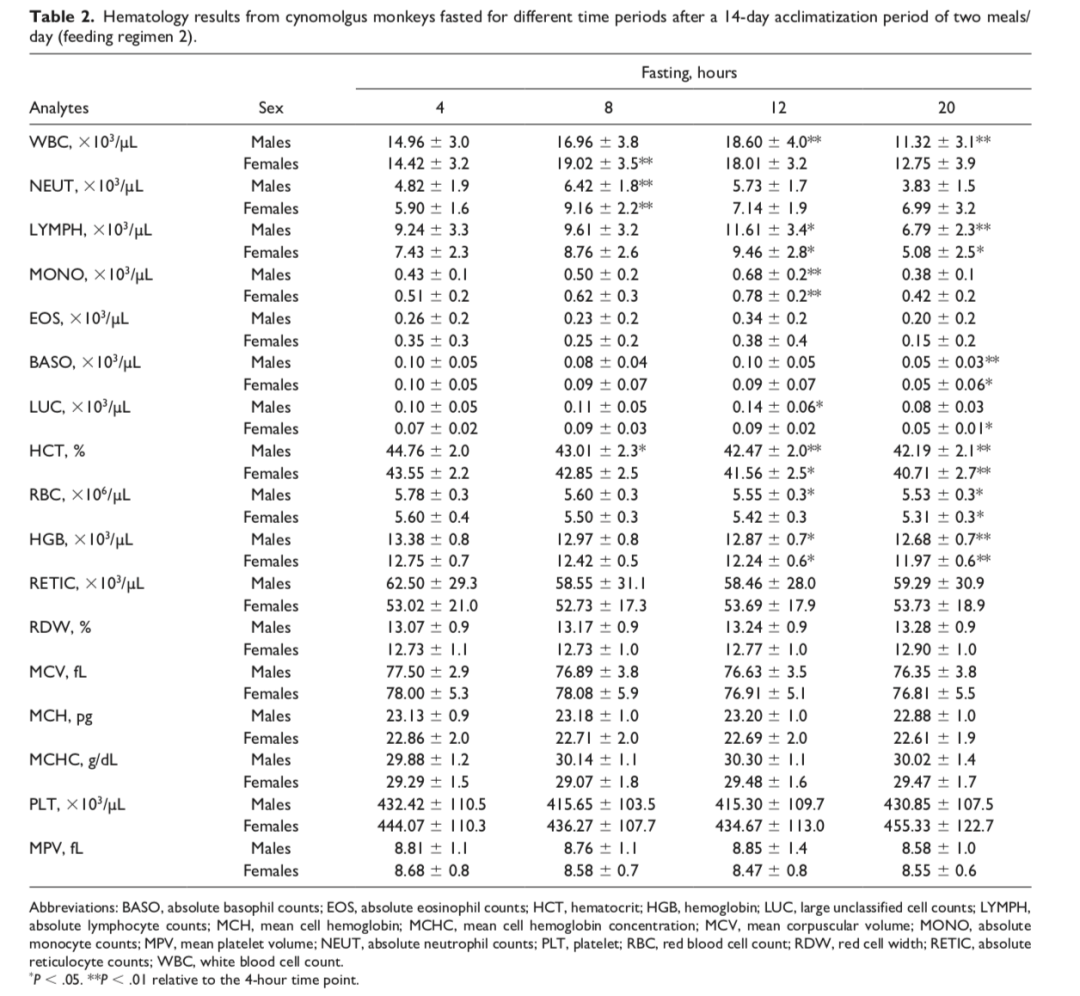
较短与较长禁食时长对血液学参数影响甚微
无论采用哪种饲喂方案,禁食时间延长至20小时都未引起所测血液学参数出现重大变化。如表1和表2所示,与4小时时间点相比,在两个阶段的雌雄猴中红细胞相关参数(HCT、HGB和RBC计数)随禁食时长呈轻微下降(降幅约7%)。这些变化被认为与实验操作相关,是24小时内频繁采血所致。其他变化包括:阶段1中禁食8小时以及阶段2中禁食8小时和12小时时,总WBC略有升高(最大增幅约1.35倍);在两个阶段中,仅雌猴在禁食8小时时NEUT计数略有升高(最大增幅约1.5倍);以及在20小时禁食时淋巴细胞计数出现轻微下降(阶段1和阶段2)。这些变化被认为是由于正常生物学变异。然而,尽管其最小性,LYMPH下降可能也与禁食相关压力有关,因为20小时时间点在两个研究阶段和两种性别中均出现一致的下降模式,以及其他支持性证据(例如,增加的皮质醇)。
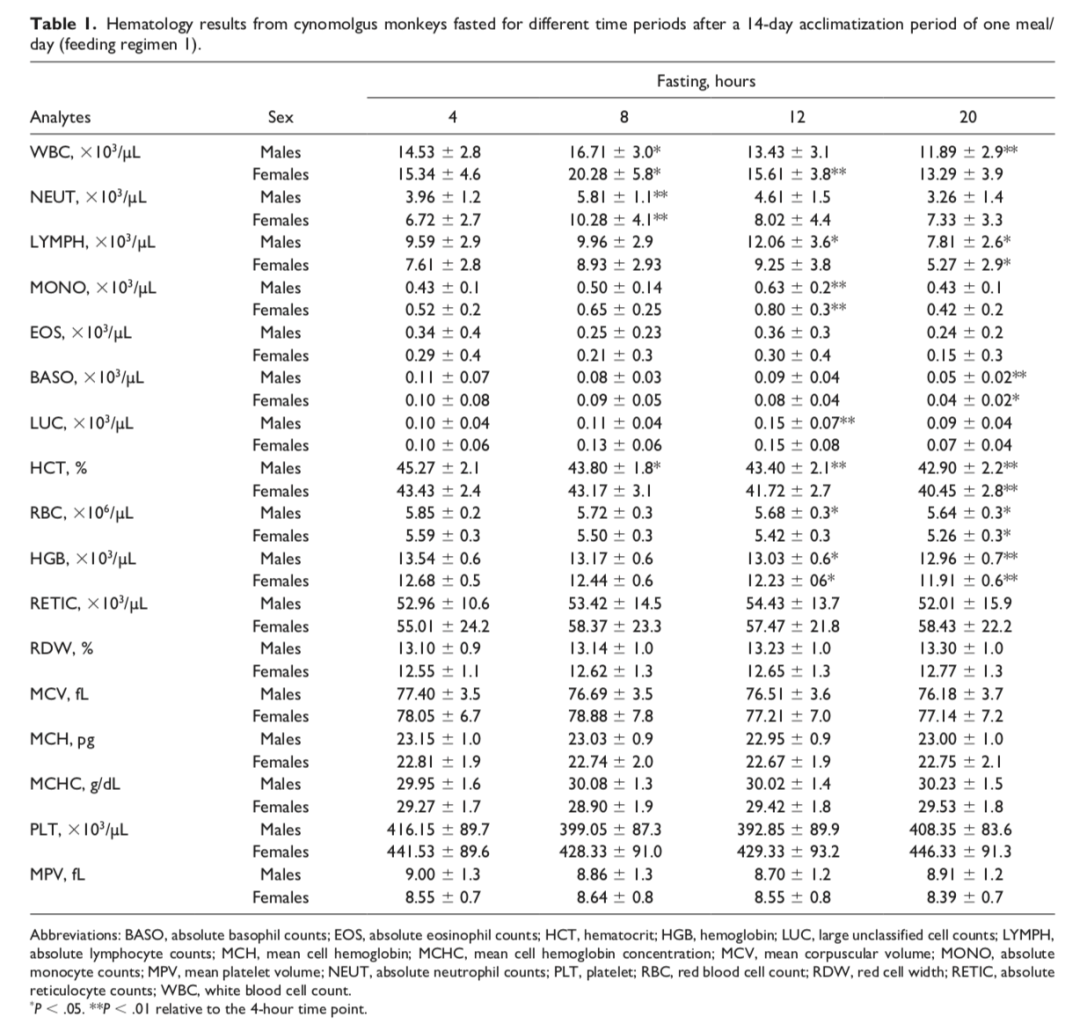
葡萄糖和无机磷酸盐血清浓度是长期与短期禁食时间最受影响的血清化学参数
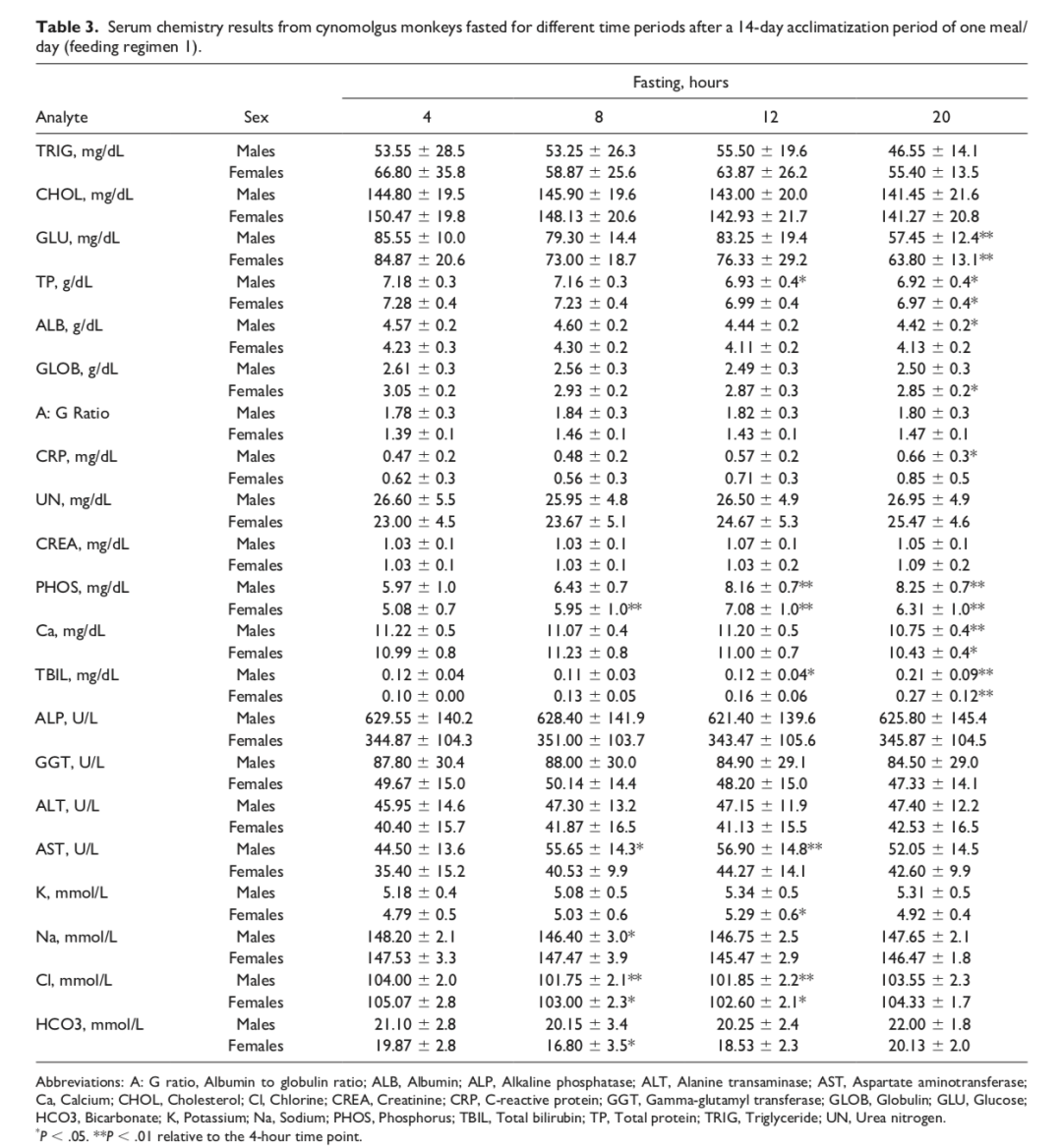
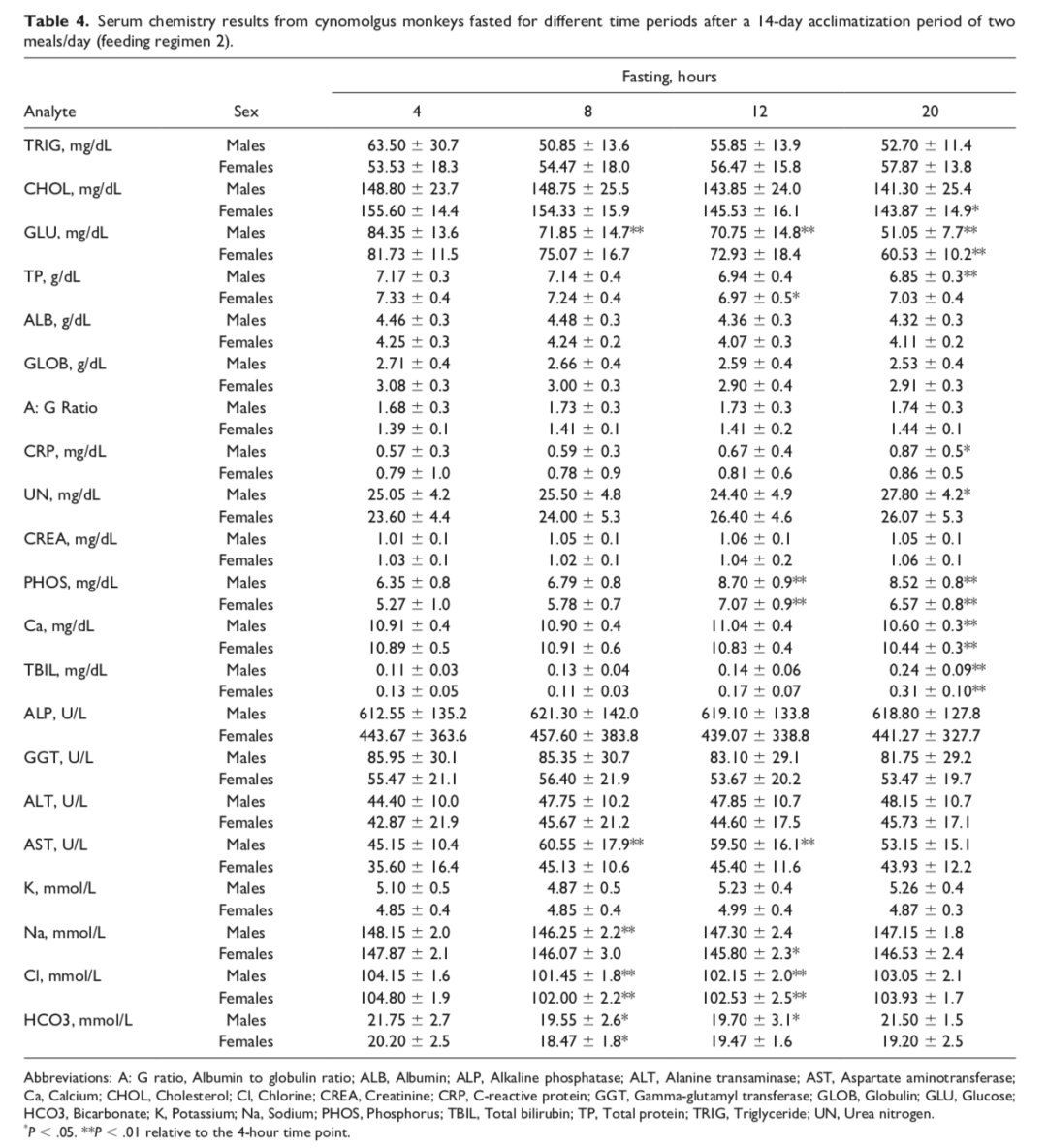
尽管总体而言,无论实验阶段如何,大多数血清生化参数在不同禁食时长下仅表现出轻微甚或没有变化,但在较长禁食时间点,血糖(GLU)和无机磷(PHOS)浓度受到了一定程度的影响。在两种饲喂方案的雌雄猴中,与4小时时间点相比,禁食20小时后GLU浓度中度降低(降幅约40%),而禁食≥12小时时P浓度略有升高(增幅最高约40%)(见表3、表4)。其他在4小时时间点无论研究阶段均受影响最小的参数包括甘油三酯(TRIG)、胆固醇(CHOL)和总胆红素(tBIL)。在两个阶段和两种性别中,TRIG浓度在第一阶段的20小时时间点以及第二阶段仅雄性的≥12小时禁食时间点出现最小下降(下降17%)(表3和4;图3)。CHOL浓度在第一阶段雌性的≥12小时禁食时间点以及第二阶段的两种性别中出现最小下降(下降约8%)。tBIL浓度在两个阶段和两种性别的20小时禁食时间点也出现最小增加(最多增加2.7倍)。尽管存在这种变化模式,但它们仍被认为在正常生物学变异范围内。
短期禁食时间与甘油三酯浓度变异性增加有关
尽管在20小时时间点的甘油三酯浓度下降被认为最小且在正常生物学变异范围内,但早期时间点的甘油三酯浓度显示出个体动物之间更高的变异性,这由更高的标准差(表3和4)和更宽的置信区间支持。在第一阶段(喂养方案1)中,与20小时时间点相比,两种性别的4至12小时时间点的变异性更高。在第二阶段(喂养方案2)中,雄性的4小时时间点以及雌性的4小时和8小时时间点的变异性更高。这些发现表明,可能需要长达12小时才能完成食蟹猴的胃肠食物消化和吸收。
葡萄糖稳态调节激素在长期与短期禁食时间的变化如预期般发生
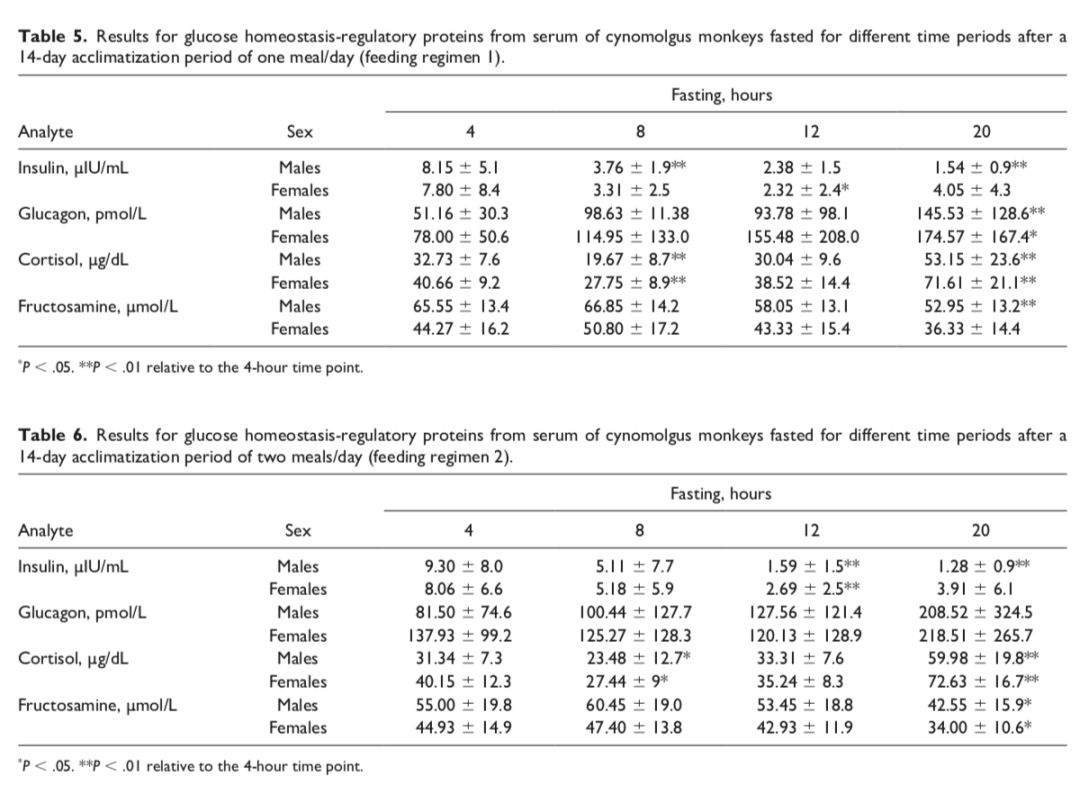
在禁食期间,来自饮食碳水化合物的葡萄糖生成量随时间减少。为了维持葡萄糖稳态并减少葡萄糖的细胞摄取,胰岛素分泌受到抑制,而皮质醇和胰高血糖素的分泌增加。为了确认这些变化,我们评估了这些激素的动力学。如表5和6所示,在两个研究阶段中,无论雄性禁食时间如何,均观察到胰岛素浓度的时间依赖性下降,最高下降出现在20小时时间点(下降约83%)。在雌性中,对于两个研究阶段,也观察到胰岛素浓度的时间依赖性下降,直到12小时时间点,在20小时时间点出现下降趋势但略有逆转但仍低于4小时(第一阶段)或≤8小时(第二阶段)时间点。对于胰高血糖素,在第一阶段的两种性别以及第二阶段的雄性中观察到时间依赖性增加(最多增加2.8倍)。在第二阶段的雌性中,仅在20小时时间点观察到胰高血糖素浓度增加(表5和6)。对于皮质醇,在两个研究阶段的两种性别中,无论禁食时间如何,在20小时时间点观察到最多约2倍的增加。总体而言,除了雌性在20小时时间点胰岛素的逆转趋势外,激素变化与禁食相关的常规知识和预期变化一致(表5和6)。
血糖胺变化与葡萄糖下降相关
血糖胺是一种糖化蛋白,由葡萄糖通过后翻译的不可逆非酶促方式与血浆蛋白(主要是白蛋白)结合形成。本质上,血糖胺的半衰期约为2-3周,与白蛋白的半衰期一致,因为其清除更多依赖于白蛋白的降解或丢失7-10,而不是葡萄糖。因此,我们假设适应期间的喂养方案类型对血糖胺浓度的影响大于20小时禁食。如表5和6所示,在4小时时间点(最接近适应期结束的时间点),第一阶段(喂养方案1)雄性的血糖胺浓度高于第二阶段(喂养方案2)雄性,而雌性的浓度在两个阶段之间相当。在理论上,如前所述,增加喂养频率应导致更高的葡萄糖和白蛋白浓度,随后血糖胺浓度更高。然而,两个喂养方案在两种性别中的4小时时间点的葡萄糖和白蛋白浓度相当。因此,我们认为第一阶段(喂养方案1)雄性的血糖胺浓度高于第二阶段(喂养方案2)雄性的差异在生物学上没有意义。在雌性中,结果表明血清白蛋白以及随后的血糖胺浓度不受适应期间每日喂养次数的影响。
禁食未引起氧化应激
某些外源化合物及其代谢物(如醌类)可直接或间接通过过量产生活性氧(ROS)引发氧化应激,导致谷胱甘肽(GSH)等抗氧化剂耗竭(10-12)。为确定14天驯化期的饲喂方案类型以及长达20小时的禁食是否会在毒理学研究中诱发氧化应激,我们测定了血清中GSH、GSSG、GSH:GSSG比值和Cys的浓度。阶段1中,结果显示在禁食≥8小时后,雌雄猴的GSH均略有下降;仅雄猴在12小时时GSSG略有增加;雄猴在禁食≥12小时时GSH:GSSG比值略有降低;半胱氨酸未见变化。阶段2中,雄猴和/或雌猴在禁食≥8小时后GSH略有降低,且GSSG无变化,导致雄猴在12小时、雌猴在20小时时GSH:GSSG比值下降;半胱氨酸依然无变化。尽管两阶段中GSH:GSSG比值出现了这些轻微变化,但谷胱甘肽相关参数并未受到实质性影响(与啮齿动物的报道一致),这表明禁食并未在食蟹猴中引发氧化应激。
讨 论
本研究中最重要的观察结果之一是4小时和20小时时间点之间甘油三酯浓度没有显著差异。由于在毒理学研究中对实验动物进行禁食的主要原因之一是确保个体动物之间可比且稳定的甘油三酯浓度基线,因此本研究中短时间和长时间禁食时间点之间血清甘油三酯没有显著差异相当令人惊讶。这可能归因于动物的低脂肪饮食摄入,因为所有猴子都喂食了PMI Nutrition International Certified LabDiet®,其中含有约5%的脂肪,被认为是低脂肪饮食。因此,作者认为对于类似营养饮食的食蟹猴,没有理由在毒理学研究中禁食超过4小时。话虽如此,早期禁食时间点的甘油三酯浓度显示出个体动物之间的更高变异性,表明胃肠食物消化和吸收可能需要长达12小时。因此,当甘油三酯被认为是毒理学研究中的关键终点,并且将基于甘油三酯评估做出重要药物开发决策时,作者建议在临床病理学评估采血前进行更长时间的禁食(>12-20小时)。
本研究中的另一个有趣观察结果是,在两个研究阶段(或喂养方案)中,无论研究阶段如何,雌性在20小时禁食时间点的胰岛素浓度都有向逆转的趋势。生理上,血液中葡萄糖浓度的增加会刺激胰岛素分泌,而胰岛素随后会促进葡萄糖被肝脏、骨骼肌、脂肪组织以及许多其他器官摄取。当由于禁食血糖下降时,胰高血糖素分泌增加,胰岛素分泌受到抑制,以维持禁食时的正常血糖。本研究中大部分观察到了这种模式。在禁食期间,胰岛素和胰高血糖素的作用之间必须保持平衡,以维持正常血糖。胰高血糖素占优势的不平衡活动在禁食期间严重影响细胞对葡萄糖的摄取,使得热量生成不足,导致全身疲劳/虚弱。因此,雌性在20小时时间点胰岛素的轻微增加可能反映了维持细胞对葡萄糖摄取的生理反应,因为雌性的葡萄糖和胰高血糖素浓度在两个研究阶段中相对于雄性略高。这可能表明,与雄性相比,雌性猴子的血糖稳态机制对低血糖的阈值更低。因此,为了避免这种可能影响动物福利的激素失衡,在没有科学依据的情况下,应优先选择较短的禁食时间,因为两种性别和研究阶段的4小时、8小时和12小时时间点的血糖浓度是相当的。谷胱甘肽(GSH)是一种由半胱氨酸、谷氨酸和甘氨酸组成的普遍存在的三肽硫醇。GSH是一种重要的细胞内和细胞外保护性抗氧化剂,参与解毒某些外源化学物和重金属、信号传导过程以及其他功能的关键作用。众所周知,某些外源化学物及其代谢产物(例如,醌类)可以直接或间接通过过度产生活性氧(ROS)导致氧化应激,从而消耗抗氧化剂,如GSH。先前的研究表明,饮食限制缺乏必需氨基酸和饥饿会导致大鼠在24小时食物剥夺后出现半胱氨酸缺乏,进而导致GSH耗竭。因此,将外源化学物给予禁食动物提供了两种可能在毒理学研究中增加氧化应激的动态,进而影响动物福利,从而影响数据质量。
为了评估禁食是否会在食蟹猴中引起与在啮齿动物中观察到的类似的GSH下降,我们评估了GSH、GSSG和GSH:GSSG比率,以及Cys浓度。结果表明,与在啮齿动物中报告的相反,谷胱甘肽参数未受到影响,表明禁食不会在食蟹猴中引起氧化应激。话虽如此,鉴于不同禁食时间之间的临床化学终点大多相当,我们仍然认为,除非有科学依据,否则不需要对食蟹猴进行超过4小时的禁食。所有其他临床病理学变化大多在20小时时间点观察到,包括与压力相关的改变(皮质醇增加和LYMPH减少)、由于脂肪动员导致肝脏胆红素摄取增加(tBIL增加)以及由于脱水导致肾小球滤过率(GFR)降低(无机磷酸盐增加)。尽管频繁处理动物以采集血液可能会对压力相关改变产生影响,但我们不认为这是本研究的情况。这是因为压力相关改变并非在最频繁处理期间(4小时之间采集血液,即4小时、8小时和12小时时间点)出现,而是在处理程序之间延长的时间段后(8小时之间采集血液)出现。尽管这些改变的幅度很小,但它们共同存在可能会对已经因暴露于高(有时是有毒的)剂量的受试物而承受压力的动物的福利产生负面影响。因此,除非有科学依据,否则不应让食蟹猴长时间禁食。我们目前正在对其他常用于非临床安全性评估的动物进行类似研究,包括比格犬、大鼠和小鼠。这些研究的结果将适时发表。由于我们的主要目标是减少禁食时间,因此我们没有在非禁食条件下(即0小时)评估临床病理学参数。鉴于此,作者认为,除非:(1)禁食对于口服受试物的生物利用度是必要的;(2)需要受非禁食条件影响的参数进行受试物的安全性和药效学评估(例如,葡萄糖、甘油三酯和胆固醇),否则对食蟹猴进行禁食可能没有必要。尽管有多个参数显示出具有统计学意义的P值,但我们只考虑了被认为具有生物学意义的变化。任何具有统计学意义的结果仅作为生物学意义的参考,必须根据相应的生物学过程合理解释,以确定其生物学意义。统计学意义并不意味着生物系统中存在真正的变化或影响。例如,血清氯化物浓度在8小时和12小时时间点的变化具有统计学意义,但在两个研究阶段的两种性别中均为统计学正常(表3和4)。这些变化被认为是正常生物学变异,因为这些变化不影响动物的健康,并且没有时间上的一致性。最近发表了一项关于食蟹猴临床病理学参数的年龄相关变化的研究,发现网织红细胞和淋巴细胞计数、肌酐、甘油三酯、磷酸盐和球蛋白浓度以及碱性磷酸酶和γ-谷氨酰转移酶活性存在差异。尽管我们没有评估禁食如何影响不同年龄组的临床病理学参数,但我们没有理由相信我们的结论会因年龄差异而受到影响。
总之,本研究评估了不同的适应实践和禁食时间对标准和辅助临床病理学参数的影响。结果表明,不同的适应实践对体重、血糖胺或其他临床病理学参数没有显著影响;长达20小时的禁食并未在食蟹猴中引起氧化应激。此外,较长的禁食时间导致压力(皮质醇增加和LYMPH减少)、肾小球滤过率降低(无机磷酸盐增加)以及葡萄糖的生物学显著下降——所有这些变化都可能影响动物福利。尽管在短时间和长时间禁食之间没有甘油三酯浓度的显著差异,但较短的禁食时间与个体动物之间更高的甘油三酯变异性有关。根据这些发现,作者建议在大多数毒理学研究中采用较短的禁食时间,除非需要受非禁食条件影响的参数进行安全性和药效学评估(例如,葡萄糖、甘油三酯和胆固醇)。
400 - 102 - 1174


咨询热线

莱
艾
特
商
城
扫
一
扫
关
注

京ICP备14028330号-1 京公网安备 11010802039490号
Copyright © 2015 All Rights Reserved www.bjlat.com 设计维护:北京莱艾特科技发展有限公司
郑重声明:引用他人的信息,本网站均已经列明出处。
转载的目的在于学术交流与讨论,若有任何侵犯您的权益之处,请与我们联系删除相关内容。
地址:北京市海淀区天秀路10号中国农大国际创业园3号楼2层2002 邮箱:info@bjlat.com 电话:010-62969989;13661392264








