- 1
- 2
- 3
- 首页
- 关于平台
平台简介
本科学实验服务平台是莱艾特科技联合中国农业大学科研团队,携手美国芝加哥大学、加拿大McMaster大学、中科院、中国检科院、北京市营养源研究所等国内外一流大学、科研机构和企业资深专家,搭建的技术服务平台。运用国内外先进技术与设备、洁净动物房和良好的实验室,为生命科学实验提供食品、药品安全评估、营养保健品功能评价、动物疫病诊断等技术服务。
- 动物实验平台
整体实验外包
动物实验操作
小动物活体成像
动物行为学
深度分析数据及论文指导
动物分组
活体成像仪使用
水迷宫
课题开展与管理
体重监测
活体成像
十字迷宫
实验方案设计指导
肿块监测
动物模型
八壁迷宫
文献分析与选题指导
实验给药操作
肠炎模型
Y迷宫
实验动物寄养
动物麻醉操作
肥胖与糖尿病模型
T迷宫
SPF级大、小鼠饲养
动物解剖及组织提取
非酒精性脂肪肝
矿场实验
SPF级大、小鼠高脂饲养
采血及分离血清
基因型鉴定
普通级兔、犬、猴、猫、猪、牛、羊饲养
尸体处理
- 病理技术平台
制片前处理
染色
尼氏染色
免疫技术
骨组织脱钙
HE染色
肥大细胞染色
免疫组化
组织脱水
番红固绿(植物/软骨)染色
苯胺蓝染色
免疫荧光(单染)
石蜡包埋
Masson染色
LFB髓鞘染色
免疫荧光(双染)
OCT包埋
天狼猩红染色
普鲁士蓝染色
免疫组化芯片
石蜡白片
PAS糖原染色
VG/EVG染色
组织冰冻切片
阿利新蓝染色
维多利亚染色
病理阅片及报告
组织冰冻切片
AB-PAS染色
von kossa染色
拍照/扫描
硬组织切片
油红O(切片)染色
茜红素染色
阅片/读片
摊片烤片
瑞氏吉姆萨染色
抗酸染色
病理诊断
切片封片
甲苯胺蓝染色
富尔根染色
病理报告
- 检测技术平台
生化分析检测
血常规检测
氨基酸 | 脂肪酸分析
药残 | 微生物检测
前处理-组织匀浆
白细胞 | 红细胞 | 血红蛋白
游离脂肪酸
盐酸克伦特罗 | 四环素
丙氨酸氨 | 天门冬氨酸基转移酶
单核细胞数 | 单核细胞比率
短链脂肪酸
莱克多巴胺 | 沙丁胺醇 | 己烯雌酚
γ-谷氨酰基转移酶 | 脂肪酶
嗜酸细胞数 | 嗜酸细胞比率
18种不饱和脂肪酸
黄曲霉素 | 伏马毒素 | 氰化物
总胆红素 | 直接胆红素
淋巴细胞数 | 淋巴细胞比率
氨基酸分析
沙门氏菌 | 细菌总数 | 大肠菌群
尿素 | 肌酐 | 总蛋白 | 白蛋白
中性粒细胞数 | 中性粒细胞比率
甘油三酯 | 总胆固醇
红细胞压积 | 淋巴细胞数
细胞流式
其它检测实验
高密度 | 低密度脂蛋白胆固醇
血小板 | 血小板平均体积
细胞培养 | 原代细胞培养
微量元素含量检测
葡萄糖 | 尿酸 | 乳酸脱氢酶
血小板体积分布宽度标准差
流式细胞培养 | 流式细胞检测
饲料概略养分分析
- 分子蛋白平台
实时荧光定量PCR
Western Blot检测服务
质粒扩增与提取
定量PCR标准曲线构建
qPCR相对定量
细胞 | 组织蛋白提取
凝胶阻滞迁移电泳(EMSA)
定量PCR标准品构建
基因组DNA抽提
Western Blot
染色质免疫沉淀(ChIP)
Taqman探针设计与合成
RNA提取+反转录
考马斯亮蓝染色
免疫共沉淀(Co-Ip)
qPCR引物设计合成
RNA提取+反转录
明胶酶谱
- 4
科学实验一站式服务平台


01检测指标概述
循环免疫复合物(circulating immune complexes,CIC)是由抗原与抗体结合形成的可溶性复合物,又称抗原-抗体复合物。在正常情况下,小尺寸的免疫复合物可被机体清除,是免疫应答清除抗原的重要机制。免疫复合物形成后可激活补体并被吞噬细胞识别吞噬:例如红细胞表面的补体受体CR1能与附着C3b/C4b的免疫复合物结合,将其运输至肝脏和脾脏的巨噬细胞进行清除。此外,单核-巨噬细胞和血小板表面的Fc受体也可结合复合物中的抗体Fc段,从而介导对复合物的摄取清除。正因为有上述清除机制,在健康状态下循环免疫复合物水平通常很低。只有在抗原-抗体大量等量存在时可能形成大网格的不溶性复合物,超出清除能力时这些复合物才会沉积于组织并引发损伤。
免疫复合物的生理功能在于协助免疫系统清除体内产生的可溶性抗原。例如慢性感染中产生的抗原与抗体结合成复合物后,被补体和细胞受体介导清除,有利于清除病原。然而,当免疫复合物过多或清除功能障碍时,复合物可沉积于血管壁、肾小球基底膜等处,引发Ⅲ型超敏反应(免疫复合物介导的超敏反应)。这类病理机制在风湿免疫疾病中很常见,例如类风湿关节炎、系统性红斑狼疮等常出现免疫复合物沉积并致组织损伤。因此CIC既是正常免疫过程的一部分,也是某些疾病状态下的致病因素。
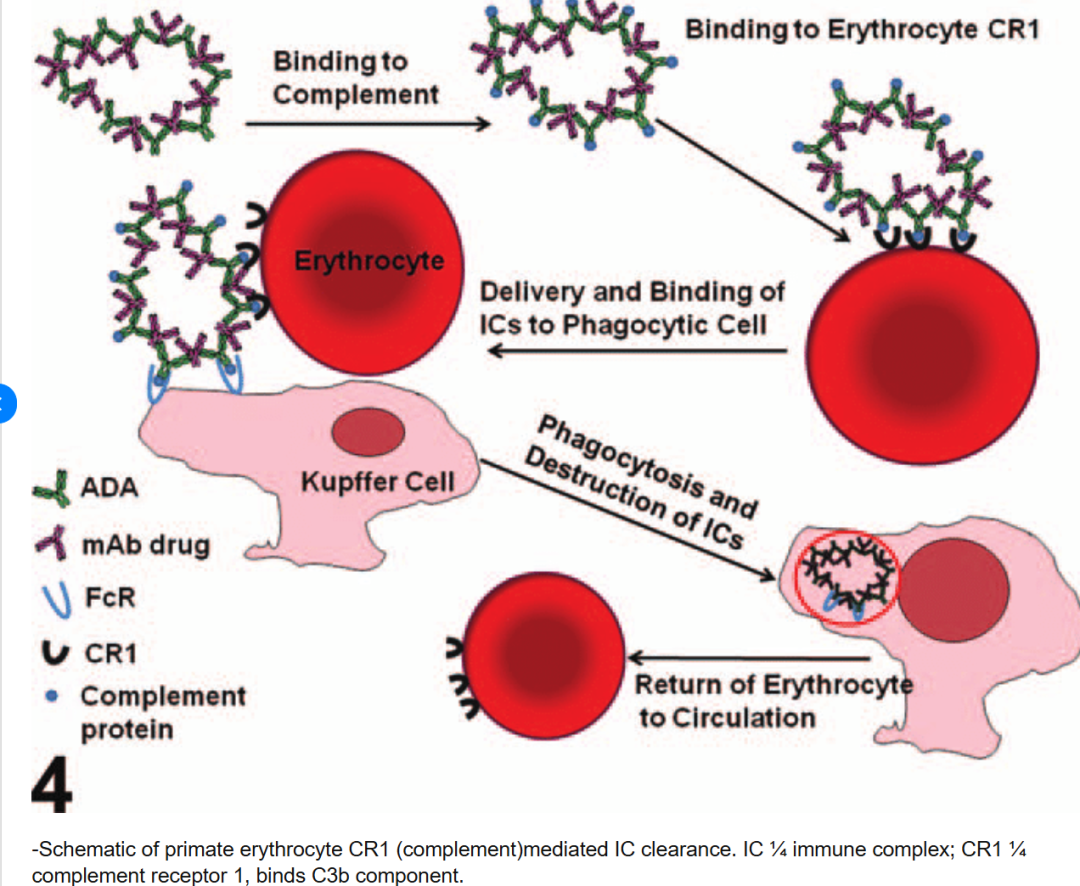
02 在临床和非临床研究中的应用场景
在临床医学中,CIC检测主要用于判断免疫复合物介导的疾病活动。传统上在自身免疫性疾病(如狼疮性肾炎)、感染后血清病以及某些慢性感染(如丙型肝炎、亚急性细菌心内膜炎)中,会检测循环免疫复合物水平以协助诊断和监测疾病活动。
在非临床毒理学研究中,CIC检测的应用日益受到重视,特别是针对生物制品(如治疗性蛋白和单克隆抗体)的安全性评价。当生物药物在动物体内诱发抗药抗体(ADA)时,可能形成含药物和抗体的免疫复合物,从而引发免疫复合物病理(Immune Complex Disease, ICD)。例如,在灵长类动物重复给药的毒性试验中,有些单抗药物在给药数周后出现动物急性过敏样反应、全身虚脱等表现,被证实与体内形成的免疫复合物激活补体有关。此时通过检测循环免疫复合物及补体活化标志,可以帮助确认反应机制。另外,在药效学研究中,如果药物作用机制涉及抗原-抗体复合物(例如治疗性抗体与可溶性靶标结合形成复合物),监测CIC有助于理解药物分布和清除动态,以及潜在的组织沉积风险。

03 种属差异
各实验动物物种由于免疫系统结构和功能的不同,其循环免疫复合物的基础水平和清除机制存在差异。总体而言,健康状态下大多数物种的CIC水平极低或接近检测下限,因为体内有高效的清除途径防止免疫复合物蓄积。然而,不同种属在清除免疫复合物的机制上有所不同:
3.1 灵长类(如人、猴): 人和非人灵长类动物的红细胞上高度表达补体受体1(CR1,CD35),这是清除免疫复合物的关键机制之一。当免疫复合物在循环中形成并结合补体C3b/C4b后,可与红细胞表面的CR1结合(即经典的“免疫黏附”现象)。红细胞携带着结合的免疫复合物在循环中运行,将其运输并移交给肝、脾的固定巨噬细胞系统进行吞噬清除。这种机制使得灵长类红细胞充当“惰性运载体”,在很大程度上避免了免疫复合物在肾、小血管等敏感组织沉积。此外,结合在红细胞上的CIC还能被协同转运至肝脏库普弗细胞和脾脏巨噬细胞吞噬,在清除过程中红细胞自身通常不被吞噬,只释放免疫复合物。这一高效运输清除系统使得健康人和猴的循环中CIC水平通常极低。只有当清除系统饱和或功能受损(如补体缺陷、CR1数量降低)时,灵长类动物才会出现显著的CIC积累和组织沉积。值得一提的是,CR1在灵长类不同个体间数量存在多态性,并可受疾病影响而改变:例如人在SLE等疾病活动时红细胞CR1显著下降,导致免疫复合物清除功能减弱,被认为是疾病严重程度的影响因素。
3.2 啮齿类(大鼠、小鼠等): 啮齿类红细胞缺乏类似人类的CR1受体,因此红细胞不参与免疫复合物清除。研究显示,小鼠将补体结合的免疫复合物主要通过血小板和巨噬细胞清除:在小鼠模型中,不易溶的免疫复合物倾向于与血小板结合,且可引发血小板活化。相应地,小鼠体内大的免疫复合物可能更容易在局部沉积并引发炎症。例如,一些小鼠品系(如NZB/W小鼠)随着年龄增长自发产生高滴度自身抗体和免疫复合物,出现免疫复合物介导的肾小球肾炎模型。由于缺乏红细胞介导的转运,小鼠和大鼠主要依赖单核-巨噬细胞系统直接从循环中捕获免疫复合物,清除效率可能低于灵长类。因此,啮齿类在暴露于高抗原抗体负荷时更容易出现免疫复合物沉积性损伤,如大鼠长期暴露某些异种蛋白后常见肾小球内免疫复合物沉积和继发肾病。
3.3 犬科动物(犬): 犬的免疫复合物清除机制与啮齿类有相似之处,也缺乏人类那样的红细胞CR1介导的大量免疫复合物转运。犬红细胞虽存在有限的补体受体但功能上不及灵长类,因此犬主要通过肝脏和脾脏的巨噬细胞清除循环中的免疫复合物。一些慢性疾病中犬会出现明显的免疫复合物血症并导致靶器官病变。例如,在自然发生的犬利什曼病(黑热病)中,病犬由于持续寄生虫抗原刺激产生高水平抗体,形成大量免疫复合物沉积于血管壁、肾小球基底膜,引发系统性血管炎、葡萄膜炎和严重的免疫复合型肾小球肾炎。
总体而言,人类与非人灵长类的CIC行为最为相似,清除高效且正常情况下水平极低。其他动物如犬、啮齿类等由于缺乏红细胞介导的清除途径,在大量抗原抗体负荷下更容易累积CIC并发生类似人类免疫复合物疾病的靶器官损伤,但也提供了用于研究这些病理过程的动物模型。例如,狗自发的免疫介导肾炎、鼠的自发性狼疮模型,都与人类CIC相关疾病有相似机制。人类方面,CIC检测主要用于疾病诊断和监测,而动物方面更多用于毒理研究中观察药物诱导的免疫反应差异。值得注意的是,不同物种免疫球蛋白类别和半衰期各异:如人和猴IgG半衰期约2-3周,而小鼠仅几天,这可能影响免疫复合物在循环中的持续时间和分布。但清除效率的关键差异还是在于是否具有红细胞CR1运输系统。因此,在跨物种外推时,要充分考虑这些免疫生理差异。例如,一种在小鼠出现严重免疫复合物沉积的药物反应,在猴体内可能被快速清除而不呈现明显毒性,反之亦可能成立。

04 检测方法与建议
4.1 常用检测技术与平台
检测循环免疫复合物的技术已有多种,主要包括免疫学方法和生化分离法等:
4.1.1 补体结合测定:最经典的是C1q结合试验,利用补体C1q可以与含IgG或IgM的免疫复合物结合的原理。具体有液相法、固相法等:液相C1q结合测定中,将放射性或酶标记的C1q与待测血清混合,C1q会结合复合物,再用聚乙二醇(PEG)沉淀结合物并测定放射活性或酶活性以推算CIC含量。固相C1q法则是将C1q包被于微孔板,捕获样本中的免疫复合物,再用抗IgG检测。C1q法优点是针对补体可结合的免疫复合物,灵敏度较高(可检测μg级复合物)且广泛应用,例如EUROIMMUN公司商业酶免疫测定即采用C1q包被ELISA检测IgG型CIC。另外补体消耗试验(抗补体试验)也是一种简单方法:将待测血清与一定量补体混合后加入致敏红细胞,如果血清中有免疫复合物则会耗固定补体,导致无法溶解致敏红细胞,不发生溶血,据此定性或定量CIC。还有胶固素结合试验利用牛血清蛋白胶固素结合C3d标记的免疫复合物来检测。总体而言,补体法特异性较好,尤其针对致病性较强的大型免疫复合物(它们往往结合补体)。C1q ELISA是目前临床和研究中应用最广的CIC检测方法之一。
4.1.2 Raji细胞法:利用人B淋巴瘤Raji细胞富含补体受体(CR2,可与C3片段结合)的特点,将待测血清与Raji细胞孵育,细胞表面结合的免疫复合物可被放射性或酶标抗体检测。
4.1.3 聚乙二醇(PEG)沉淀法:利用较高浓度PEG使免疫复合物沉淀,然后测定沉淀中IgG含量来反映CIC水平。例如一些研究将血清加2-4% PEG后离心,测定上清与沉淀的光学密度或Ig浓度差值来量化复合物。该方法简单且对各种大小复合物均有一定捕获能力,但可能一起沉淀非特异性蛋白,特异性需注意。现代改进是结合ELISA:如先用PEG富集复合物,再用抗IgG或抗补体片段的ELISA检测,提高特异性。
4.1.4 抗原/抗体特异ELISA:针对已知会形成免疫复合物的特定抗原-抗体对,可设计双夹心或桥接ELISA。例如在生物药物研究中,可通过桥接法检测复合物:将药物抗原包被板上,捕获复合物中结合的抗药抗体,再用抗IgG检测;或反之用抗体捕获复合物中结合的药物再检测药物量。这些方法可以定性区分复合物是否包含特定成分(如药物和ADA)。Pierog等开发的检测猴血清中药物特异性免疫复合物的方法,就结合了两种免疫测定手段,提高了检出率。
4.1.5 质谱和补体裂解产物检测:直接利用质谱鉴定循环复合物较困难,因为复合物大小异质且浓度低。但可通过间接指标如补体活化的裂解片段C3a、C4a、C5a水平来推断体内是否有免疫复合物大量形成并激活补体。有研究建议在疑有免疫复合物病变时,同时检测这些过敏毒素以及炎症细胞因子,以辅助判断免疫复合物引起的全身炎症反应
4.2 方法选择与推荐理由
在具体应用中,应根据研究目的和物种选择合适的CIC检测方法:
4.2.1 特定复合物检测:在明确知道复合物成分时(如某治疗性抗体在猴体内可能与其靶抗原形成复合物),应设计特异检测。例如针对药物-抗药抗体复合物,桥接ELISA可直接证明药物和抗体已形成复合物。这种方法有助于区分免疫复合物病变是由ADA免疫反应引起,还是药物本身机制导致(两种情况对人临床意义不同)。当要求较高灵敏度和药物耐受性时,可考虑酸解离-检测等技术:先将复合物解离再分别测ADA和药物,从而捕获被复合物“隐藏”的抗体或抗原。
4.2.2 多指标联合:鉴于免疫复合物检测各法有局限,重要决策时常采用多指标佐证。推荐同时观察临床病理学改变(如补体C3/C4消耗、类风湿因子升高、肾脏尿蛋白等)以及组织病理(免疫荧光/IHC下复合物沉积)结果,与CIC检测结合综合研判。尤其在毒理研究中,如发现可疑免疫复合物相关病理损伤,可通过血清CIC水平、补体碎片、抗药抗体滴度等的组合变化来增强因果推断的可靠性。
05 物种差异与方法局限性
在不同物种上开展CIC检测时,需要注意试剂和方法学的种属适用性。许多商用CIC检测试剂(如人用C1q ELISA试剂盒)针对人免疫球蛋白和补体设计,对动物样本可能存在交叉反应不足或背景偏高的问题。例如,人C1q可能与人和猴的IgG复合物结合良好,但小鼠IgG的补体结合位点序列不同,检出效率可能下降。因此,检测啮齿类时最好采用针对小鼠/大鼠校验过的方法或试剂。
另一常见干扰是类风湿因子(RF)等自身抗体的影响。RF为抗IgG的自身抗体,可与IgG形成复合物。因此在某些物种(如易发自身免疫的老年鼠或灵长类)中,RF可能使CIC测定出现假阳性。PEG沉淀法尤其会共同沉淀RF-IgG复合物而提高读数。为此,可在检测前预先去除类风湿因子,或在结果分析时结合同时测得的RF水平进行校正。
方法学局限方面,需认识到CIC检测阳性并不一定意味着有疾病过程。正常个体偶尔也可检测到少量循环免疫复合物,可能是无害的生理清除产物。例如临床上将CIC结果阳性作为辅助诊断指标时,常需结合症状和其它实验室异常才能确定病理意义。同样地,在动物毒理试验中,CIC升高若未伴随组织沉积和损伤迹象,可能只是抗药抗体反应的标志,对安全性无实质影响。此外,不同CIC检测方法对大中小尺寸复合物的敏感性各异,有时会出现结果不一致的情况。因此在研究报告中应说明所用方法原理,以便正确解释数据。例如C1q法偏向补体结合的大型复合物,如果阴性而临床怀疑有小复合物,则可换用更灵敏的其他方法确认。
06毒性研究中的评价价值
6.1 毒性研究中的评价价值: 在药物非临床安全性评价中,CIC指标的变化往往提示免疫介导的毒理学效应。尤其对于生物制品(如单克隆抗体、融合蛋白等),动物可能对人源或异源蛋白产生抗药抗体(ADA),进而与药物抗原形成免疫复合物。
6.2 大量循环免疫复合物的形成会带来两方面影响:(1)影响药物药代动力学:免疫复合物可加速药物清除或改变其分布。比如ADA-药物复合物被巨噬细胞系统清除,导致有效暴露降低。(2)引发免疫复合物病理反应:如在猴长期毒性试验中观察到,某人源化抗体由于形成免疫复合物而引起免疫复合物性肾小球肾炎、血管炎等病变。
CIC的检测可作为早期预警信号——当动物出现原因不明的发热、关节肿胀、皮疹或尿蛋白等症状时,检测血清CIC和补体是否激活,有助于判定是否发生了类血清病样反应。
在常规毒理试验中,如果发现组织病理有免疫复合物沉积迹象(例如肾小球内见荧光免疫球蛋白和补体沉积),应追溯检查血中CIC水平,从而支持机制判断。一些案例表明,在猴子等高灵敏物种中,大剂量给药结合高抗原负荷确实可能诱发明显的免疫复合物疾病。因此ICH和FDA等指南均强调在生物制品毒理研究中关注免疫复合物相关病变,必要时进行专项分析。例如,ICH S6(R1)提到如果动物出现免疫复合物病(如血管炎、肾小球肾炎)的证据,应考虑对抗药抗体和免疫复合物进行分析。这样的检测结果不仅用于解释毒性机制,也可用于指导临床风险:若在非临床阶段即见明显免疫复合物介导毒性,则临床需警惕类似反应并制定监测措施(如监测患者CIC、补体水平等)。
07 法规与指南参考
国际和国内多项指南对免疫复合物相关的免疫原性反应有所涉及,强调了其在非临床安全性评价中的处理原则:
7.1 ICH S6 (R1)《生物制品的非临床安全性评价》:作为生物药物毒理研究的指导原则,其中明确提出在解释安全性数据时,需要关注免疫复合物形成和沉积导致的病理变化。指南强调动物出现抗药抗体是常见现象,不应仅因检测到抗体或免疫复合物就提前终止试验,除非它们严重影响了药物暴露或研究判读。换言之,应将此类免疫反应视为研究的一部分进行评估和记录。S6指出动物产生抗体并不必然预示人体也会产生,相反,人对人源蛋白的耐受性通常更高,发生严重免疫复合物疾病(如严重血清病)的概率在人临床较低。基于此,指南建议当发现因免疫复合物导致的毒性时,要评估其人相关性:若被认定为动物种属特有现象,可在申报资料中加以说明,以免过度解读对人风险。
7.2 FDA《治疗蛋白质产品免疫原性评估指南》(2014):美国FDA在该指南中讨论了免疫复合物介导的不良反应,指出当患者出现可疑免疫复合物疾病体征(如延迟性发热、皮疹、关节痛等),应考虑进行循环免疫复合物和补体激活的实验室检测。这一原则同样适用于非临床研究:如果在动物中观察到延迟性的超敏反应迹象,检测CIC和补体可帮助确认机制。FDA还提醒,已有病例报告显示治疗性单抗诱发了免疫复合物性肾小球肾炎和血管炎等并发症。因此,在开发新的生物制品时,需要有策略地监测和应对潜在的免疫复合物相关风险,比如在长期毒理研究中增加相关检测,并在一旦出现可疑反应时深入调查。
7.3 ICH S8《免疫毒性研究指南》:该指南关注药物对免疫系统的影响,主要聚焦免疫抑制和免疫增强。但其精神同样提示我们,对于可能引起免疫复合物相关毒性的药物,应当在非临床阶段充分表征免疫系统反应,包括需要时增加如抗体反应、组织免疫沉积的检查。中国NMPA发布的生物药物免疫原性评价指南草案中,也引用了ICH的观点,强调免疫原性发现的处理:当动物出现免疫介导的组织损伤时,应结合免疫复合物检测等手段确认,并评估其对临床的意义,以决定是否需要额外的研究支持。
7.4 专业学会共识:美国毒理病理学会(STP)和美国兽医临床病理学会(ASVCP)等也在相关出版物中对免疫复合物指标有所讨论。例如,有综述总结了非临床研究中免疫介导反应的行业经验,建议在报告中区分免疫复合物病变与药理毒性,并提出在灵长类研究中遇到免疫复合物相关的损伤,可参考既往案例妥善解读。这些共识有助于指导报告撰写和与监管机构沟通,确保对CIC相关发现的解释符合科学原理并获得认可。
总的来说,法规和指南对循环免疫复合物指标的态度是:重视其在非临床研究中的发现,但要理性解读。一方面,要求研究者充分监测可能的免疫复合物介导效应,以免遗漏安全信号;另一方面,又强调对其人临床相关性的判断,不能因为动物出现免疫复合物毒性就武断终止开发。在实际的新药评价中,这意味着CIC检测结果及相关病理需要在申报资料中详细报告,并结合指南精神进行讨论,说明其对人风险的预测程度,从而为监管决策提供依据。
400 - 102 - 1174


咨询热线

莱
艾
特
商
城
扫
一
扫
关
注

京ICP备14028330号-1 京公网安备 11010802039490号
Copyright © 2015 All Rights Reserved www.bjlat.com 设计维护:北京莱艾特科技发展有限公司
郑重声明:引用他人的信息,本网站均已经列明出处。
转载的目的在于学术交流与讨论,若有任何侵犯您的权益之处,请与我们联系删除相关内容。
地址:北京市海淀区天秀路10号中国农大国际创业园3号楼2层2002 邮箱:info@bjlat.com 电话:010-62969989;13661392264








