- 1
- 2
- 3
- 首页
- 关于平台
平台简介
本科学实验服务平台是莱艾特科技联合中国农业大学科研团队,携手美国芝加哥大学、加拿大McMaster大学、中科院、中国检科院、北京市营养源研究所等国内外一流大学、科研机构和企业资深专家,搭建的技术服务平台。运用国内外先进技术与设备、洁净动物房和良好的实验室,为生命科学实验提供食品、药品安全评估、营养保健品功能评价、动物疫病诊断等技术服务。
- 动物实验平台
整体实验外包
动物实验操作
小动物活体成像
动物行为学
深度分析数据及论文指导
动物分组
活体成像仪使用
水迷宫
课题开展与管理
体重监测
活体成像
十字迷宫
实验方案设计指导
肿块监测
动物模型
八壁迷宫
文献分析与选题指导
实验给药操作
肠炎模型
Y迷宫
实验动物寄养
动物麻醉操作
肥胖与糖尿病模型
T迷宫
SPF级大、小鼠饲养
动物解剖及组织提取
非酒精性脂肪肝
矿场实验
SPF级大、小鼠高脂饲养
采血及分离血清
基因型鉴定
普通级兔、犬、猴、猫、猪、牛、羊饲养
尸体处理
- 病理技术平台
制片前处理
染色
尼氏染色
免疫技术
骨组织脱钙
HE染色
肥大细胞染色
免疫组化
组织脱水
番红固绿(植物/软骨)染色
苯胺蓝染色
免疫荧光(单染)
石蜡包埋
Masson染色
LFB髓鞘染色
免疫荧光(双染)
OCT包埋
天狼猩红染色
普鲁士蓝染色
免疫组化芯片
石蜡白片
PAS糖原染色
VG/EVG染色
组织冰冻切片
阿利新蓝染色
维多利亚染色
病理阅片及报告
组织冰冻切片
AB-PAS染色
von kossa染色
拍照/扫描
硬组织切片
油红O(切片)染色
茜红素染色
阅片/读片
摊片烤片
瑞氏吉姆萨染色
抗酸染色
病理诊断
切片封片
甲苯胺蓝染色
富尔根染色
病理报告
- 检测技术平台
生化分析检测
血常规检测
氨基酸 | 脂肪酸分析
药残 | 微生物检测
前处理-组织匀浆
白细胞 | 红细胞 | 血红蛋白
游离脂肪酸
盐酸克伦特罗 | 四环素
丙氨酸氨 | 天门冬氨酸基转移酶
单核细胞数 | 单核细胞比率
短链脂肪酸
莱克多巴胺 | 沙丁胺醇 | 己烯雌酚
γ-谷氨酰基转移酶 | 脂肪酶
嗜酸细胞数 | 嗜酸细胞比率
18种不饱和脂肪酸
黄曲霉素 | 伏马毒素 | 氰化物
总胆红素 | 直接胆红素
淋巴细胞数 | 淋巴细胞比率
氨基酸分析
沙门氏菌 | 细菌总数 | 大肠菌群
尿素 | 肌酐 | 总蛋白 | 白蛋白
中性粒细胞数 | 中性粒细胞比率
甘油三酯 | 总胆固醇
红细胞压积 | 淋巴细胞数
细胞流式
其它检测实验
高密度 | 低密度脂蛋白胆固醇
血小板 | 血小板平均体积
细胞培养 | 原代细胞培养
微量元素含量检测
葡萄糖 | 尿酸 | 乳酸脱氢酶
血小板体积分布宽度标准差
流式细胞培养 | 流式细胞检测
饲料概略养分分析
- 分子蛋白平台
实时荧光定量PCR
Western Blot检测服务
质粒扩增与提取
定量PCR标准曲线构建
qPCR相对定量
细胞 | 组织蛋白提取
凝胶阻滞迁移电泳(EMSA)
定量PCR标准品构建
基因组DNA抽提
Western Blot
染色质免疫沉淀(ChIP)
Taqman探针设计与合成
RNA提取+反转录
考马斯亮蓝染色
免疫共沉淀(Co-Ip)
qPCR引物设计合成
RNA提取+反转录
明胶酶谱
- 4
科学实验一站式服务平台











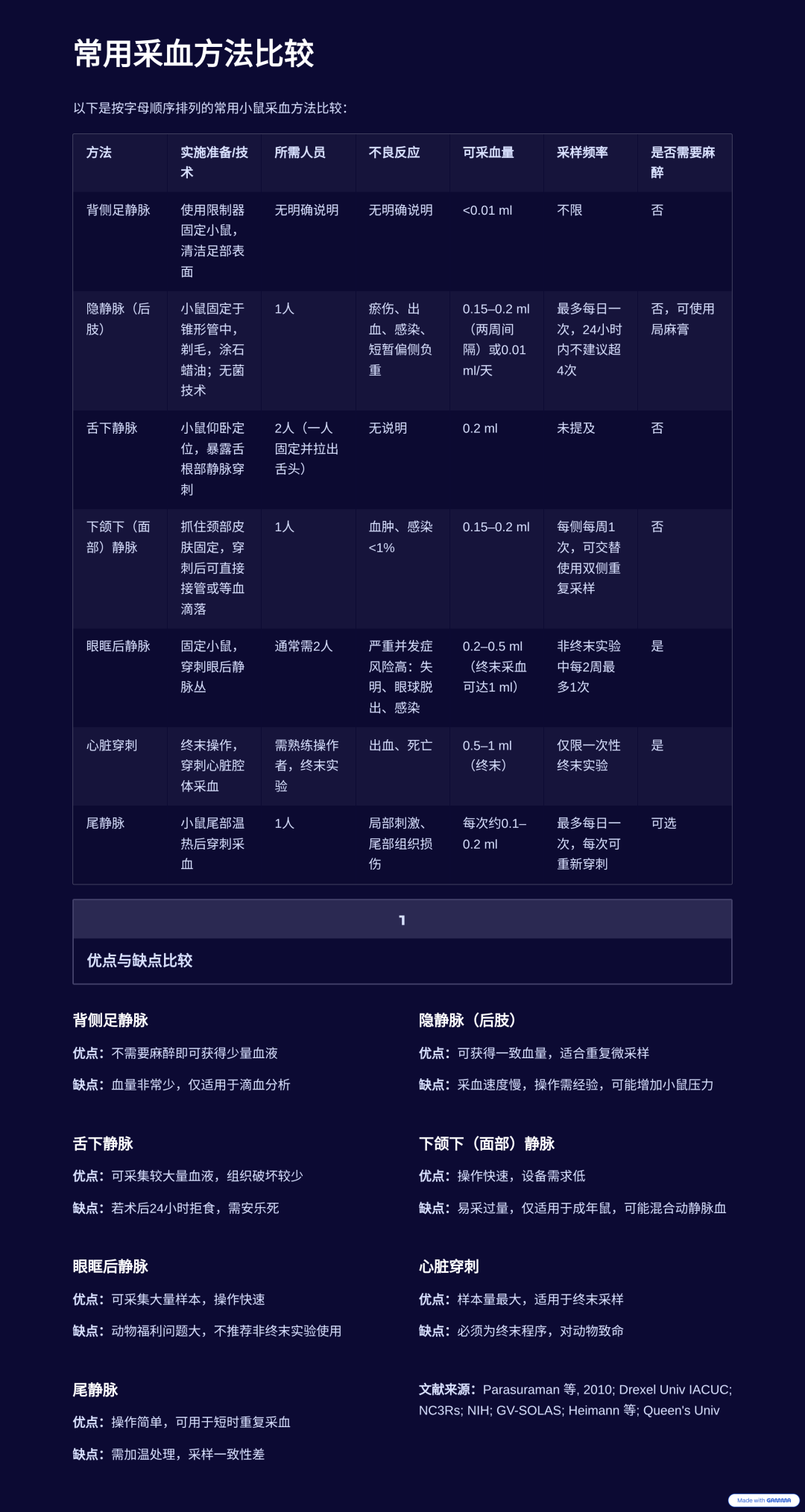
小鼠采血方法流程图



400 - 102 - 1174


咨询热线

莱
艾
特
商
城
扫
一
扫
关
注

京ICP备14028330号-1 京公网安备 11010802039490号
Copyright © 2015 All Rights Reserved www.bjlat.com 设计维护:北京莱艾特科技发展有限公司
郑重声明:引用他人的信息,本网站均已经列明出处。
转载的目的在于学术交流与讨论,若有任何侵犯您的权益之处,请与我们联系删除相关内容。
地址:北京市海淀区天秀路10号中国农大国际创业园3号楼2层2002 邮箱:info@bjlat.com 电话:010-62969989;13661392264








