

- 首页
- 关于我们
- 丰容产品
- 动物笼器具
- 动物实验器械
- 仪器设备
- 病理产品
- 试剂耗材
- 实验服务
- 莱艾特学院


一、Walter F. Loeb
(美国)
(一)教育背景与职业履历
1955年获宾夕法尼亚大学兽医学博士(VMD)
1956年获俄亥俄州立大学硕士(MS)
1965年获密歇根州立大学病理学博士(PhD)曾任教于俄亥俄州立大学兽医学院,并担任兽医临床病理实验室主任
1970年加入 Litton Bionetics(美国重要政府科研承包机构),负责临床病理实验室建设,为NIH(美国国立卫生研究院)、FDA(美国食品药品监督管理局)的毒理研究项目提供临床病理支持
1988年共同创立 Ani Lytics 公司 ——这是一家针对临床病理和毒理学测试的专业 CRO,为政府和制药产业的毒理研究提供服务。
在其50 余年的职业生涯中,Loeb 博士发表近 50 篇论文、16 个书籍章节,并共同主编了毒理临床病理史上最重要的教材之一。
(二)学术与方法学核心贡献(毒理临床病理)
Walter F. Loeb被公认为毒理临床病理学(toxicologic clinical pathology)的奠基人之一,其有主编里程碑教材《实验动物临床化学》(The Clinical Chemistry of Laboratory Animals)。目前发行两版,第 1 版发行于1989年和第 2 版发行于1999年。该书首次系统整合实验动物血液学、生化、尿液指标在毒理研究中的解释逻辑,成为全球 GLP 实验室的标准参考。
在革命性思想贡献方面,他明确指出 不能将“医院检验学的参考区间”直接套用于毒理学研究。在其经典论文中,他系统阐述了毒理临床病理应关注同组对照(concurrent control)、时间趋势(time-course)和生物学意义(biological relevance),而不是“是否超出正常参考范围”,这一思想至今仍是 GLP 审评、IND/NDA 毒性解释的核心哲学基础。
👉 How useless are reference ranges in preclinical safety studies?(1997)

(三)荣誉与学术任职
ASVCP(美国兽医临床病理学会)主席
ACVP(美国兽医病理学会)杰出会员
AACC 动物临床化学杰出贡献奖
Charles Louis Davis 基金会 Thompson 奖
Walter F. Loeb 定义了“毒理临床病理 ≠ 医院检验学”的学科哲学。
二、 Jiro J. Kaneko
(美国)
(一)教育背景与职业履历
加州大学戴维斯分校(UC Davis)首届兽医毕业生
在 UC Davis 获得学士(BS)、兽医学博士(DVM)和博士(PhD,1959 年,研究乳蛋白生物合成)
1957–1994 年长期任 UC Davis 临床病理学教授
建立 UC Davis 教学医院临床病理服务体系
ACVP 临床病理学创始认证专家之一(1974)
(二)学术与方法学核心贡献
Kaneko主编全球最经典的临床生化教材之一的《家畜临床生物化学》Clinical Biochemistry of Domestic Animals(1963 起,已至第 6 版)。该书首次系统建立了多物种(鼠、犬、牛、马等)生化指标的正常范围体系,将“物种差异(species difference)”作为解释毒理数据的核心前提。他强调“在毒理学中,脱离物种背景谈‘异常’,是没有意义的。”,其研究涉及红细胞寿命、铁代谢、能量代谢和比较病理生理。
1983 年共同创立国际动物临床病理学会(ISACP),推动全球学术交流。
(三)荣誉
ASVCP 创始成员
AACC 动物临床化学教育终身成就奖(1994)
欧洲兽医临床病理学会 名人堂
UC Davis 杰出校友奖
“Kaneko 奖”以其名义设立,用于奖励青年学者
Kaneko 为毒理临床病理提供了“什么是正常”的科学地基。
三、 Kurt W. Weingand
(美国|宝洁)
(一)教育与职业
兽医学博士(DVM)
病理学博士(PhD)
曾任教于 Wake Forest 与 Kansas State
1989 年加入 宝洁(P&G)毒理学部门,长期担任核心毒性与临床病理专家
(二)学术与方法学核心贡献
他被誉为:“毒理临床病理国际统一化(Harmonization)之父”,并主导 1996 年划时代论文,该论文首次在全球范围内明确:在毒性研究中哪些血液学 / 生化 / 凝血指标是“必须检测项”以及采样时间、频率、解释原则。该工作直接奠定了:FDA、ICH、OECD以及非临床临床病理检测的共识基础。
他让全球毒理临床病理“说同一种语言”:
👉 Harmonization of Animal Clinical Pathology Testing in Toxicity Studies

四、Toshiaki Matsuzawa 松泽俊明
(日本|Yamanouchi Pharmaceutical / Astellas 体系)
(一)教育背景与职业履历
松泽俊明(Toshiaki Matsuzawa,常见引文写作 T. Matsuzawa)是日本毒理临床病理领域的代表性科学家之一。他长期在日本制药工业体系内工作,曾在 Yamanouchi Pharmaceutical Co.(山之内制药,后并入安斯泰来 Astellas) 的安全性研究系统中负责/领导毒理临床病理相关工作,并作为行业专家参与日本制药企业协会(JPMA)的多项非临床安全项目。其职业轨迹更偏“行业标准建设者 + 数据库建设者 + 国际协调代表”,在日本毒理临床病理体系的现代化过程中影响巨大。
(二)学术与方法学核心贡献(毒理临床病理)
松泽教授最重要的贡献可以概括为三条主线:
1. 建立日本实验动物临床病理“参考数据体系/数据库”
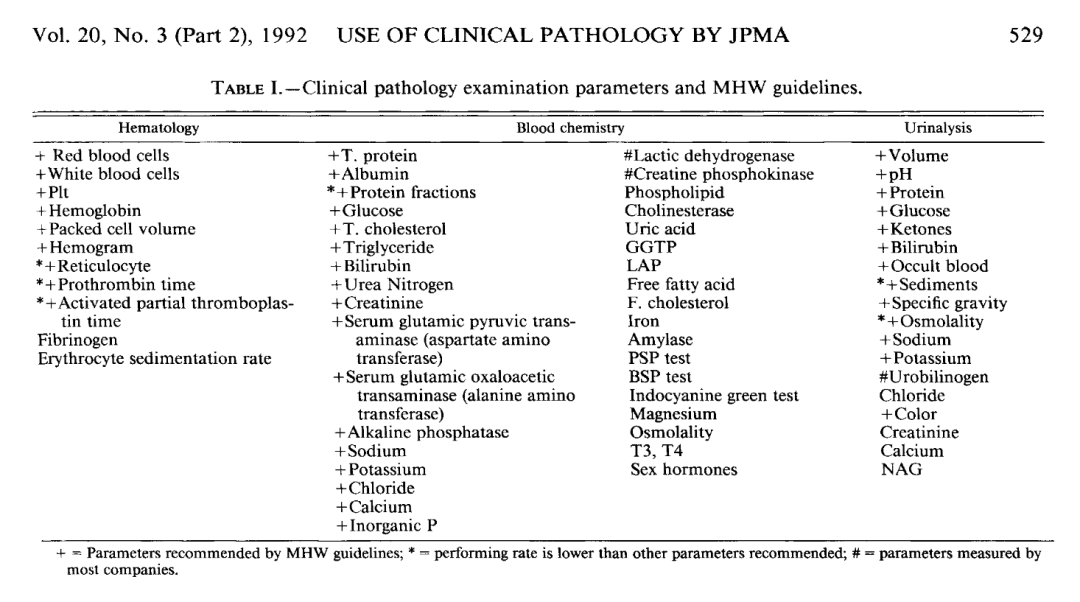
2. 他推动并组织了日本国内多实验室的临床病理数据汇总,形成可用于安全性研究对照解释的参考范围与变异评估框架。
这类工作对 GLP 的意义非常直接,即让日本不同公司、不同实验室的临床病理数据具有可比性,为解释“个体差异 vs 药物相关变化”提供了证据基础和强调“方法差异/前分析因素”对参考区间的影响。
松泽体系特别强调实验动物临床病理参考值不是“天然存在”的,而是与动物品系、年龄、饲养条件采血时间(昼夜节律)、应激仪器平台与方法学密切相关。这实际上与 Loeb 的理念一脉相承,这一理念便是毒理临床病理必须基于研究语境解释,而不是套一个“正常范围”。
3. 作为日本代表参与国际协调(Harmonization)
他是日本方面的重要代表之一,参与 1990 年代国际毒理临床病理协调工作(与 Weingand 等人主导的国际共识相互对接),使日本临床病理实践与欧美主流标准逐步统一。这件事的价值在于日本公司向 FDA/ICH 通道提交资料时,临床病理数据的指标体系与解释逻辑更易被监管接受。
(三)荣誉与影响(偏行业标准与组织贡献)
他在日本毒理/毒理病理学界长期担任核心委员与专家角色(具体头衔多出现在 JPMA、学会工作组、指南制定团队中)。
他在日本体系里的影响相当于用数据库和行业共识把毒理临床病理从‘经验活’变成‘可复用体系’。
他让日本毒理临床病理“有了自己的参考体系,并与全球标准对齐”。
五、 Jean-Pierre Braun
(法国|图卢兹兽医学院 ENVT)
(一)教育背景与职业履历
法国兽医临床病理学家,长期任职于图卢兹国立兽医学院(ENVT),负责临床病理实验室与教学科研。
他是欧洲兽医临床病理学会(ESVCP)体系的重要奠基成员之一,推动欧洲临床病理专业化与质量体系建设。
他的学术标签非常清晰:“前分析/分析质量控制 + 标准化 + 可比性”,这对毒理临床病理尤为关键。
(二)学术与方法学核心贡献(毒理临床病理)
Braun 的贡献集中在“把临床病理做成像计量科学一样严谨”,核心包括以下内容:
1. 系统研究并提出“前分析阶段”是最大误差来源
在The preanalytic phase in veterinary clinical pathology中,他强调在毒理研究中,临床病理结果最容易被采血部位、采血难度与溶血抗凝剂选择与混匀方式标本放置时间/运输温度动物禁食与否、昼夜节律抓取/保定造成的应激反应等因素扭曲。他的贡献在于把这些因素系统化、条目化、可操作化,并推动实验室在 SOP 中显式控制与记录,从而让 GLP 资料更经得起审计。
2. 推动仪器验证、单位/命名标准化与跨实验室可比性
Braun 强调不同平台、不同方法学会造成系统偏倚(bias),在毒理研究中会影响历史对照数据的可用性多中心研究数据合并外包与委托实验室数据一致性。因此他倡导对自动血球仪、生化仪的验证/确认(verification/validation)单位、项目名称、报告格式进行统一,使毒理临床病理“更像标准化工程”。
3. 推动参考区间/变异度的科学使用
他并非简单追求“给出一个参考值”,而是强调生物学变异(within/between individual variation)统计学构建参考区间的方法在毒理研究中何时用 RI、何时更应依赖同组对照与趋势,这使得毒理临床病理解释更可靠,减少误报与漏报。
(三)荣誉与影响
他在欧洲体系里被视为“质量与标准化”代表人物之一,影响了欧洲毒理临床病理与兽医临床实验室的规范化路径。其学术影响更偏“方法学标准”和“实验室质量文化”。
他让毒理临床病理真正变成一门“可控误差、可重复、可审计”的实验科学。
六、William J. Reagan
(美国|Pfizer 辉瑞)
(一)教育背景与职业履历
兽医背景 + 临床病理专科路径(在药企安全性评价体系长期任职)。
在 辉瑞(Pfizer) 毒理与药物安全研发体系中担任全球/核心临床病理领导角色,负责非临床研究临床病理策略数据解释与风险评估与项目团队/监管沟通中的临床病理论证
(二)学术与方法学核心贡献(毒理临床病理)
Reagan 的贡献非常“监管友好”,核心是把经验转成可复用的最佳实践和牵头/参与 ASVCP / STP 多项 Best Practice 指南。这些指南覆盖样本采集与处理规范、数据报告与可视化和恢复期(recovery phase)。如何安排临床病理评估与如何将临床病理与其它终点(体重、临床观察、组织病理)整合并推动“骨髓评价/血液系统毒性”在毒理临床病理中的标准化(Best practices for evaluation of bone marrow in nonclinical toxicity studies)。
他参与推动骨髓检查在安全性评价中的规范化。其中包括何时做骨髓、如何取材(穿刺/涂片)、如何定量与描述和如何与外周血变化对照解释。关键议题是临床病理变化是否构成“Adversity(不良/有害效应)”?(Principles for Assessing Adversity in Toxicologic Clinical Pathology)
Reagan 参与/推动形成共识,包括很多指标变化是适应性(adaptive)而非有害(adverse),“统计显著”不等于“毒理显著”和需要结合幅度、持续性、可逆性、与组织/功能证据的相关性来判断,这直接对应 GLP 报告里最难写、监管最爱问的一句话:“这些临床病理改变,是否提示不良毒性?其机制与临床相关性是什么?”
(三)荣誉与影响
在 STP/ASVCP 的指南制定与学术交流中属于关键人物,影响了行业对“adversity 判定”的统一语言。他把临床病理从“报异常”推进到“解释异常是否构成毒性风险”。
七、Nancy E. Everds
(美国|Amgen / Seagen;曾任 STP 主席)
(一)教育背景与职业履历
兽医学背景,完成临床病理专科训练;在工业界长期从事生物药/新机制药物的安全性评价。
职业路径横跨大型药企与生物技术公司:
DuPont、Roche(早期)
Amgen(安进):临床病理方向关键岗位
Seattle Genetics / Seagen:非临床科学与安全体系
罕见地以临床病理背景担任 STP(毒理病理学会)主席 ——反映了她在行业影响力与跨学科领导力。
(二)学术与方法学核心贡献(毒理临床病理)
Everds 的核心贡献集中在生物药时代的毒理临床病理难题:
1. 免疫毒性与血液学异常的解释框架
生物药、抗体和免疫调节剂常导致外周血细胞谱变化(淋巴细胞、单核细胞、中性粒等)、细胞因子介导的急性反应和免疫复合物相关变化。这些变化往往容易与“应激、感染、操作”混淆。她推动形成更精细的解释思路有两个,一个是区分免疫药理效应 vs 毒性效应,另一个是结合流式、细胞因子、组织学证据解释。
2. 非人灵长类(NHP)临床病理变异性与应激因素研究
她强调在 NHP 研究中要注意运输、抓取、保定、采血方式造成的应激和生理节律与个体差异,因为它们能显著影响血液学与生化结果。
3. 推动数据呈现与监管沟通的可解释性
在 STP 层面推动更好的数据呈现与解释方式,使临床病理结果更可被项目团队与监管理解。
我最喜欢的文献里面至少有以下10篇是她参与的:
1: Kurien BT, Everds NE, Scofield RH. Experimental animal urine collection: a review. Lab Anim. 2004
2: Everds NE. Deciphering Sources of Variability in Clinical Pathology-It's Not Just about the Numbers. Toxicol Pathol. 2017
3: Troth SP, Everds NE, Siska W, Knight B, Lamb M, Hutt J. Scientific and Regulatory Policy Committee Points to Consider: Data Visualization for Clinical and Anatomic Pathologists. Toxicol Pathol. 2018
4: Everds NE, Tarrant JM. Unexpected hematologic effects of biotherapeutics in nonclinical species and in humans. Toxicol Pathol. 2013
5: Pandiri AR, Kerlin RL, Mann PC, Everds NE, Sharma AK, Myers LP, Steinbach TJ. Is It Adverse, Nonadverse, Adaptive, or Artifact? Toxicol Pathol. 2017
6: Tripathi NK, Everds NE, Schultze AE, Irizarry AR, Hall RL, Provencher A, Aulbach A. Deciphering Sources of Variability in Clinical Pathology. Toxicol Pathol. 2017
7: Everds NE, Snyder PW, Bailey KL, Bolon B, Creasy DM, Foley GL, Rosol TJ, Sellers T. Interpreting stress responses during routine toxicity studies: a review of the biology, impact, and assessment. Toxicol Pathol. 2013
8: Hall RL, Everds NE. Factors affecting the interpretation of canine and nonhuman primate clinical pathology. Toxicol Pathol.
9: Everds NE. Evaluation of clinical pathology data: correlating changes with other study data. Toxicol Pathol. 2015
10: Ladics GS, Stadler JC, Makovec GT, Everds NE, Buck RC. Subchronic toxicity of a fluoroalkylethanol mixture in rats. Drug Chem Toxicol. 2005
(三)荣誉与影响
作为 STP 主席、行业专家,她让临床病理在毒理病理的大框架中占据更高话语权及让毒理临床病理真正进入“生物药/免疫治疗时代”,并把复杂免疫反应讲清楚。
八、Lindsay C. Tomlinson
(美国|Pfizer;“下一代形态”代表)
(一)教育背景与职业履历
她是现代药企体系中的毒理临床病理领导型人物之一,长期在 Pfizer 的药物安全研发体系工作,活跃于 ASVCP / STP 的方法学工作组与指南制定,是连接“传统临床病理”与“新技术/新模型”的关键角色。
(二)学术与方法学核心贡献(毒理临床病理)
1. ASVCP 最佳实践白皮书第一作者(行业级影响)
她牵头形成“药企与生物技术公司适用的毒理临床病理最佳实践”,覆盖从采样到解释到报告的一整套流程。特别强调研究设计变量对结果的影响(禁食、采样点、采血量、重复采样)前分析/分析质量控制统计解释与毒理解释的区分
2. 微量采血(micro-sampling)与动物福利/研究效率
她推动在小鼠、幼龄动物、重复取样场景下用更小血量获得可靠数据,降低动物消耗和增强纵向趋势分析能力,其举动更贴近现代毒理研究设计(尤其是新机制药与探索性研究)
3. 新模型:器官芯片/微生理系统(MPS)与毒理临床病理的结合
她推动 pathologist 参与 MPS 的验证与解释,选择与体内可对标的生物标志物和定义“损伤信号”与“背景波动”,让替代模型更具监管可接受性
4. 数字病理与 AI
她关注如何将数字化与 AI 用于提升临床病理/细胞学评估效率与一致性(Deep Learning Methodology for Quantification of Normal Pancreas Structures.)
(三)荣誉与影响
她推动毒理临床病理从“传统检测”走向“微量化、模型创新、AI 赋能”,并代表“下一代毒理临床病理学者”所倾向的技术融合、替代模型和数据科学化的方向。
九、 Lila Ramaiah
(美国|强生;毒理临床病理规则化代表)
(一)教育背景与职业履历
临床病理与毒理学交叉背景(DVM/PhD 路径),在药企与 CRO 体系均有工作经历。
其职业标签是“共识框架制定者 + 新型安全性生物标志物推动者”
(二)学术与方法学核心贡献(毒理临床病理)
她是“Adversity 判定框架”第一作者/核心推动者(Principles for Assessing Adversity in Toxicologic Clinical Pathology.)
她牵头形成行业共识,其内容有什么样的临床病理改变应被定义为 adverse、哪些属于适应性或药理效应和需要怎样的证据链支持结论,这一框架最大的贡献是把过去依赖资深专家“经验判断”的事情转变为可以培训、可以复核、可以在监管沟通中引用的“规则语言”。
她推动肝损伤新标志物GLDH、miR-122 等,因为传统 ALT/AST 有一定的局限性,譬如AST 受肌肉影响和ALT 在某些情境敏感性与特异性不足。
她推动 GLDH(更偏肝细胞线粒体释放)与 miR-122(肝特异 microRNA)用于更早、更特异的肝损伤检测与跨物种转化解释。这类工作与 FDA biomarker qualification(生物标志物监管认证路径)高度相关,属于“临床病理从检测走向转化科学”的代表。
(三)荣誉与影响
她的影响常体现在:很多药企今天写 IND/NDA 毒理总结里用的 adversity 判定语言、证据结构、以及肝损伤探索性标志物策略,都能看到她推动的框架痕迹。
她把“经验判断”升级为“可解释、可复用、可监管沟通”的结构化规则。
十、 A. Eric Schultze
(美国|Eli Lilly 礼来;数据质量与批次效应专家)
(一)教育背景与职业履历
他在大型药企(礼来)长期从事毒理临床病理与安全性评价数据解释,兼具“临床病理专家 + 数据质量/试验设计顾问”属性。(Toxicologic Pathology Forum*: Opinion on Qualitative Severity Descriptors to Express Magnitude of Changes in Clinical Pathology Endpoints in Nonclinical Toxicity Studies),并深度参与 STP 的科学与监管政策相关工作,是把“真实世界研究噪音”纳入行业共识的人。
(二)学术与方法学核心贡献(毒理临床病理)
Schultze 的贡献非常“实战”,解决的是毒理研究里最让人头疼的情况(即数据看起来异常,但可能不是药引起的),提出并系统阐述:nuisance factors / block effects / batch effects(干扰因素/区组效应/批次效应)。他强调在毒理临床病理数据中,以下因素会制造“假信号”:首先是不同技术员、不同批次试剂,其次是仪器维护/校准状态变化,再次是环境温湿度波动以及最后是采血顺序、处理时间差异,这些会导致某一批样本整体偏高/偏低,造成“看似处理组异常”的错觉,给出可操作的研究设计与统计策略来降低批次效应如区组随机化、跨批次平衡、关键指标重复测量、批次记录与追溯等。这对 GLP 的意义是让偏差调查更有抓手,让 QA 审计时可以解释“为什么这批动物总是怪怪的”,降低错误结论带来的研发决策风险和强调临床病理与组织病理的整合解释。
他推动形成临床病理变化不能孤立判断和需要与组织病理、器官重量、临床观察、药代暴露等共同构建证据链观点,这使得 toxicity conclusion 更稳健、更可辩护。
(三)荣誉与影响
他对行业最大的价值在于:把“噪音管理”做成方法学共识,让毒理临床病理更接近“信号科学”。
他专门解决“批次/噪音导致的假异常”,让临床病理解释更可靠、更可审计。



400 - 102 - 1174


咨询热线

莱
艾
特
商
城
扫
一
扫
关
注

京ICP备14028330号-1 京公网安备 11010802039490号
Copyright © 2015 All Rights Reserved www.bjlat.com 设计维护:北京莱艾特科技发展有限公司
郑重声明:引用他人的信息,本网站均已经列明出处。
转载的目的在于学术交流与讨论,若有任何侵犯您的权益之处,请与我们联系删除相关内容。
地址:北京市海淀区天秀路10号中国农大国际创业园3号楼2层2002 邮箱:info@bjlat.com 电话:010-62969989;13661392264






























































